题目内容
对反应A+3B 2C来说,下列反应速率中最快的是( )
2C来说,下列反应速率中最快的是( )
A.v(A)=0.3 mol/(L·min) B.v(B)=0.6 mol/(L·min)
C.v(C)=0.5 mol/(L·min) D.v(A)=0.01 mol/(L·s)
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案下表中物质的分类组合完全正确的是
A | B | C | D | |
酸 | H3PO4 | CH3COOH | NaHSO4 | HNO3 |
碱 | Mg(OH)Cl | NaOH | Fe(OH)3 | KOH |
盐 | CuSO4•5H2O | BaSO4 | NaH2PO4 | Na2S |
氧化物 | H2O | KClO3 | CuO | H2O2 |
对氮、碳及其化合物的研究具有重要意义。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g)△H1K1
N2H4(g)+O2(g)=N2(g)2H2O(g)△H2K2
则2N2H4(g)+ N2O4(g)=3N2(g)+ 4H2O(g) △H= (用△H1、△H2表示),该反应的化学平衡常数K = (用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2和CO2,实现除污,每生成1molN2还原剂失去电子数为 。
(3) 大气污染物氮氧化物可以用活性炭还原法处理。某研究小组向某2L的密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
N2(g)+CO2 (g)。在T1℃时,反应进行到不同时间(t)测得各物质的物质的量(n)如下
t(min) n(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 2.00 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
0~10min内,NO的平均反应速率v(NO)= ;T1℃时,该反应的平均常数K= 。
②30min后,只改变某一条件,反应重新达到平衡,根据上表的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.恒温时,充入一定量的氦气 d.加入适量的催化剂
(4)氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O,放电时,该电池正极的电极反应式为 。
(5)不能作为判断反应达到化学平衡状态的依据是 (填字母序号)。
A.容器内CO2的浓度保持不变
B.v正(N2)=2v逆(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变


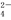
 。若加入少量醋酸钠固体,则CH3COOH
。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,K变小
CH3COO-+H+向左移动,α减小,K变小 CO2(g)+H2。达到平衡时生成0.67mol CO2,若
CO2(g)+H2。达到平衡时生成0.67mol CO2,若 在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为
在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为 B、1.0mol C、0.94mol D、0.52mol
B、1.0mol C、0.94mol D、0.52mol mol·L-1 B.
mol·L-1 B. mol·L-1
mol·L-1 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1