题目内容
【题目】(1)基态Fe原子有________个未成对电子,Fe3+的电子排布式为 ________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为________。
(2)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍, d与c同族;e的最外层只有1个电子,但次外层有18个电子。b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(3)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
请回答下列问题:
Y基态原子的电子排布式是_____;Z所在周期中第一电离能最大的主族元素是______。
(4)基态硼原子的电子排布式为______。Ga基态原子的核外电子排布式是______。Cu+基态核外电子排布式为________。
【答案】 4 1s22s22p63s23p63d5 血红色 N  1s22s22p4 Cl 1s22s22p1 1s22s22p63s23p63d104s24p1 1s22s22p63s23p63d10
1s22s22p4 Cl 1s22s22p1 1s22s22p63s23p63d104s24p1 1s22s22p63s23p63d10
【解析】(1)基态Fe原子有4个未成对电子,Fe3+的电子排布式为1s22s22p63s23p63d5 。可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色。
(2)周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,则a可能为H元素;b的价电子层中的未成对电子有3个,则b可能为N元素;c的最外层电子数为其内层电子数的3倍,c可能为O元素; d与c同族则d可能为S元素;e的最外层只有1个电子,但次外层有18个电子,则e一定是Cu元素。综合以上信息,a、b、c、d、e分别为H、N、O、S、Cu,所以b、c、d中第一电离能最大的是N,e的价层电子轨道示意图为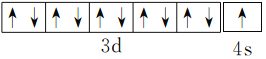 。
。
(3)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3,则X为N元素、Y为O元素。Z基态原子的M层与K层电子数相等,则Z为Mg元素;R2+离子的3d轨道中有9个电子,则R为Cu元素。所以Y基态原子的电子排布式是1s22s22p4;Z所在周期中第一电离能最大的主族元素是Cl。
(4)基态硼原子的电子排布式为1s22s22p1。Ga基态原子的核外电子排布式是1s22s22p63s23p63d104s24p1 。Cu+基态核外电子排布式为1s22s22p63s23p63d10。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】氨的合成是人类科学技术上的一项重大突破。其原理如下:
N2( g) +3H2( g) ![]() 2NH3( g) △H= -92.4kJ/mol
2NH3( g) △H= -92.4kJ/mol
据此回答下列与NH3有关的问题:
(1)该反应的化学平衡常数表达式为K =_________ 。
(2)①500℃时,若把10molN2与20molH2置于体积为10L的密闭容器内,测得容器内压强随时间的变化关系如下表:
压强/MPa | 9.6 | 8.4 | 7.6 | 7.0 | 6.4 | 6.4 | 6.4 | 6.4 |
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
则从反应开始到平衡这段时间内,v(H2)=_________mol/(L·min)。若达到平衡后,再充人5mol N2与10molH2,再次达到平衡时NH3的体积分数与原平衡状态相比_____(填“增大”“减小”或“不变”)。
②合成氨反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下列图示正确的是_____(填“A”或“B”);比较p1、p2的大小关系:_____________。

③某温度下,在恒压的某密闭容器中投入等物质的量的N2和H2,一段时间后测得H2的体积分数为40%,之后保持不变,则达到平衡时H2的转化率为________________。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料,与水在一定条件下可以生成氨气:
CO(NH2)2(s)+H2O(l)![]() 2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
2NH3(g)+CO2(g) △H = +133.6kJ/mol。关于该反应,下列说法正确的
是______(填序号)。
a.从反应开始到达到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中再加入少量CO(NH2)2,平衡正向移动
c.降低温度使尿素的转化率减小
d.恒温恒容时,向平衡体系中再充人少量氨气,平衡常数减小
(4)将氨气溶于水得到氨水,是一种弱碱。常温下,现将amol/L氨水和0.01mol/L盐酸等体积混合后,溶液中c(NH4+)=c(Cl-),则氨水的Kb=_____________。(用含a的代数式表示)




