题目内容
如图是元素周期表的框架,依据元素周期表回答下列问题:
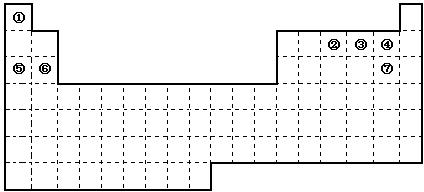
(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(2)请写出②的氢化物的电子式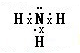
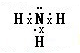 ,③的氢化物的结构式
,③的氢化物的结构式
(3)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是
(4)②形成的气态氢化物的检验方法为

(1)周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
NaOH>Mg(OH)2
NaOH>Mg(OH)2
(用化学式表示),周期表中的元素④和元素⑦的氢化物的沸点高低顺序是HF>HCl
HF>HCl
(用化学式表示).(2)请写出②的氢化物的电子式
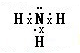
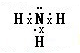
H-O-H
H-O-H
.(3)①~⑦元素的单质,在常温下化学性质稳定,通常可用作保护气的是
N2
N2
(填写分子式).(4)②形成的气态氢化物的检验方法为
用湿润的红色石蕊试纸检验,试纸若变蓝,则证明有氨气
用湿润的红色石蕊试纸检验,试纸若变蓝,则证明有氨气
.分析:根据元素周期表知①、②、③、④、⑤、⑥、⑦分别是H、N、O、F、Na、Mg、Cl元素,
(1)同一周期中,金属的金属性越强,则金属的最高价氧化物的水化物的碱性越强;
同一主族元素中,氢化物的沸点与其相对分子质量成正比,但含有氢键的物质其熔沸点高;
(2)氨气和水都是共价化合物;
(3)键能越高的气体,其性质越稳定;
(4)②形成的气态氢化物是氨气,氨气是碱性气体,能使湿润的红色石蕊试纸变蓝色.
(1)同一周期中,金属的金属性越强,则金属的最高价氧化物的水化物的碱性越强;
同一主族元素中,氢化物的沸点与其相对分子质量成正比,但含有氢键的物质其熔沸点高;
(2)氨气和水都是共价化合物;
(3)键能越高的气体,其性质越稳定;
(4)②形成的气态氢化物是氨气,氨气是碱性气体,能使湿润的红色石蕊试纸变蓝色.
解答:解:根据元素周期表知①、②、③、④、⑤、⑥、⑦分别是H、N、O、F、Na、Mg、Cl元素,
(1)同一周期中,金属的金属性随着原子序数的增大而减小,金属的金属性越强,则金属的最高价氧化物的水化物的碱性越强,所以氢氧化钠的碱性大于氢氧化镁;
同一主族元素中,氢化物的沸点与其相对分子质量成正比,但含有氢键的物质其熔沸点高,氟化氢的相对分子质量小于氯化氢,但氟化氢中含有氢键,氯化氢中不含氢键,所以氟化氢的沸点大于氯化氢;
故答案为:NaOH>Mg(OH)2;HF>HCl;
(2)②的氢化物是氨气,其电子式为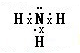 ,③的氢化物的氢化物是水,水分子中每个氢原子和氧原子形成一个共价键,所以其结构式为H-O-H,
,③的氢化物的氢化物是水,水分子中每个氢原子和氧原子形成一个共价键,所以其结构式为H-O-H,
故答案为: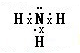 ;H-O-H;
;H-O-H;
(3)①~⑦元素的单质,氮气的键能较大,所以在常温下,氮气化学性质稳定,一般不和其它物质反应,所以通常可用作保护气的是N2,故答案为:N2;
(4)氨气是碱性气体,能和水反应生成一水合氨,一水合氨电离出氢氧根离子,红色石蕊试纸遇碱变蓝色,所以可以用湿润的红色石蕊试纸检验氨气,
故答案为:用湿润的红色石蕊试纸检验,试纸若变蓝,则证明有氨气.
(1)同一周期中,金属的金属性随着原子序数的增大而减小,金属的金属性越强,则金属的最高价氧化物的水化物的碱性越强,所以氢氧化钠的碱性大于氢氧化镁;
同一主族元素中,氢化物的沸点与其相对分子质量成正比,但含有氢键的物质其熔沸点高,氟化氢的相对分子质量小于氯化氢,但氟化氢中含有氢键,氯化氢中不含氢键,所以氟化氢的沸点大于氯化氢;
故答案为:NaOH>Mg(OH)2;HF>HCl;
(2)②的氢化物是氨气,其电子式为
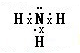 ,③的氢化物的氢化物是水,水分子中每个氢原子和氧原子形成一个共价键,所以其结构式为H-O-H,
,③的氢化物的氢化物是水,水分子中每个氢原子和氧原子形成一个共价键,所以其结构式为H-O-H,故答案为:
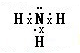 ;H-O-H;
;H-O-H; (3)①~⑦元素的单质,氮气的键能较大,所以在常温下,氮气化学性质稳定,一般不和其它物质反应,所以通常可用作保护气的是N2,故答案为:N2;
(4)氨气是碱性气体,能和水反应生成一水合氨,一水合氨电离出氢氧根离子,红色石蕊试纸遇碱变蓝色,所以可以用湿润的红色石蕊试纸检验氨气,
故答案为:用湿润的红色石蕊试纸检验,试纸若变蓝,则证明有氨气.
点评:本题考查了氨气的检验、电子式的书写、碱性强弱的判断等知识点,正确推断元素是解本题关键,结合元素周期律来分析解答即可,难度不大.

练习册系列答案
相关题目







