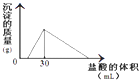
题目内容
【题目】在NH4Cl溶液中,离子浓度大小排队正确的是( )
A. c(NH4+)> c(Cl-)> c(OH-)> c(H+)
B. c(Cl-)> c(NH4+)> c(OH-)> c(H+)
C. c(Cl-)>c(NH4+)> c(H+)> c(OH-)
D. c(NH4+)> c(Cl-)> c(H+)> c(OH-)
【答案】C
【解析】氯化铵溶于水完全电离出相等的铵根离子和氯离子。铵根离子会水解,所以c(Cl-)>c(NH4+)。水解后溶液显酸性,所以c(H+)> c(OH-)。溶液的离子浓度大小为:c(Cl-)>c(NH4+)> c(H+)> c(OH-),选项C正确。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: 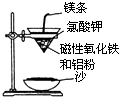
(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是 .
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为 .
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I﹣+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8molL﹣1 KI溶液、0.1molL﹣1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A﹣C三组实验,部分实验数据如下表:
编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 | 出现蓝色时间/s |
A | 39 | 10 | 5 | 5 | 1 | 5 |
B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
C | 5 | 10 | 5 | 5 | 1 | 39 |
D | t |
①为确保A组实验在39℃下进行,应采用的控温操作方法是 .
②A﹣C三组实验时,都加入了5mL水,其目的是 .
③B组实验中“没出现蓝色”,原因是 .
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
(3)⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.