题目内容
9.在0℃和101kPa的条件下,将2g氢气、1.4g氮气和1.6g氧气混合,该混合气体的体积是( )| A. | 6.72L | B. | 24.4L | C. | 10.08L | D. | 13.44L |
分析 根据n=$\frac{m}{M}$计算2g氢气、1.4g氮气和1.6g氧气的物质的量,从而得到混合气体总物质的量,再根据V=nVm计算体积.
解答 解:2.00g氢气的物质的量=$\frac{2g}{2g/mol}$=1mol、
1.40g氮气的物质的量=$\frac{1.4g}{28g/mol}$=0.05mol、
1.60g氧气的物质的量=$\frac{1.6g}{32g/mol}$=0.05mol,故标况下,混合气体的体积=(1mol+0.05mol+0.05mol)×22.4L/mol=24.4L,
故选B.
点评 本题考查物质的量的有关计算,侧重对基础知识的巩固,注意对公式的理解与灵活应用,题目难度不大.

练习册系列答案
相关题目
19.液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图装置①.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列有关叙述不正确的是( )
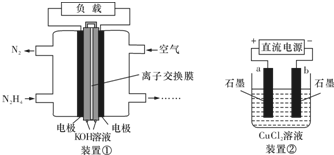

| A. | 该燃料电池负极发生的电极反应为:N2H4+4OH--4e-═N2↑+4H2O | |
| B. | 用该燃料电池作为装置②的直流电源,产生7.1g Cl2至少需加入0.5 mol N2H4 | |
| C. | 该燃料电池中,电子从左侧电极经外电路流向右侧电极,溶液OH-迁移到左侧 | |
| D. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
20.用惰性电极解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )
| A. | ZnCl2[ZnSO4] | B. | NaOH[H2O] | C. | CuCl2[HCl] | D. | CuSO4[Cu(OH)2] |
17.有机物A是合成二氢荆芥内酯的重要原料,其结构简式 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加酸性高锰酸钾溶液,后加银氨溶液,微热 | |
| B. | 先加溴水,后加酸性高锰酸钾溶液 | |
| C. | 先加银氨溶液,微热,再加入溴水 | |
| D. | 先加入新制氢氧化铜,微热.酸化后再加溴水 |
4.下列物质不能用玻璃器皿贮存的是( )
| A. | 苛性钠 | B. | 氢氟酸 | C. | 浓硫酸 | D. | 硝酸铵 |
1.向0.1mol•L-1FeI2溶液中通入一定量的Cl2.下列离子方程式与事实不符的是( )
| A. | 2I-+Cl2═I2+2Cl- | B. | 2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | ||
| C. | 2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | D. | 2Fe2++8I-+5Cl2═2Fe3++4I2+10Cl- |
18.双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3.关于该物质的说法正确的是 ( )
| A. | 该物质属于两性氢氧化物 | |
| B. | 该物质是Al(OH)3和Na2CO3的混合物 | |
| C. | 1mol NaAl(OH)2CO3最多可消耗4mol H+ | |
| D. | 1mol NaAl(OH)2CO3最多可消耗4mol H+ |

