题目内容
【题目】常温下向10mL 0.1molL﹣1CH3COONa溶液中,不断通入HCl后,CH3COO﹣与CH3COOH浓度的变化趋势如图所示(不考虑溶液体积变化),下列说法不正确的是( ) 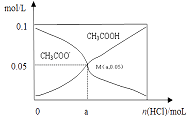
A.M点溶液中水的电离程度比原溶液小
B.在M点时,c(H+)﹣c(OH﹣)=(100a﹣5.0×10﹣2) mol/L
C.随着HCl的通入, ![]() 值不断减小
值不断减小
D.当n(HCl)=1.0×10﹣3mol时,溶液中c(Na+)>c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣)
【答案】D
【解析】解:A.CH3COO﹣水解促进水的电离,CH3COOH电离出氢离子抑制水的电离,原溶液为醋酸钠溶液,醋酸根离子水解促进水的电离,M点溶液显酸性,醋酸电离的氢离子抑制水的电离,所以M点溶液中水的电离程度比原溶液小,故A正确;
B.在M点时,溶液中存在电荷守恒为c(Na+)+c(H+)=c(Cl﹣)+c(CHCOO﹣)+c(OH﹣),则c(H+)﹣c(OH﹣)=c(Cl﹣)+c(CHCOO﹣)﹣c(Na+)=100a+0.05﹣0.1=(100a﹣5.0×10﹣2) mol/L,故B正确;
C.温度不变,水解常数Kh= ![]() 不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以
不变,随着HCl的加入,CH3COOH浓度逐渐增大,所以 ![]() 逐渐减小,故C正确;
逐渐减小,故C正确;
D.当n(HCl)=1.0×10﹣3mol时,CH3COONa与HCl恰好反应生成等浓度的NaCl和CH3COOH,由于CH3COOH部分电离溶液显酸性,所以c(Na+)=c(Cl﹣)>c(CHCOO﹣)>c(H+)>c(OH﹣),故D错误.
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.