题目内容
把金属M放入盐N(NO3)2溶液中,发生如下反应:M+N2+====M2++N,以下叙述正确的是( )A.常温下金属M和N都不跟水反应
B.M和N用导线连接放入稀H2SO4中,一定构成原电池,且N极上有H2放出
C.M和N用导线连接并平行放入M(NO3)2溶液中,一定构成原电池
D.由M和N构成的原电池,M一定是负极,且N上一定产生H2
解析:A项,若N能与水反应,则M更易与水反应,结果要产生N(OH)2沉淀,由方程式可知M、N都不与水反应;B项,原电池内应发生氧化还原反应,若M、N分别为Cu和Ag,则都不与H2SO4发生反应,故不能构成原电池;C项,由题干给出的方程式知不能构成原电池;D项,若电解质溶液为中性或很弱的酸性,则N极上发生的反应是2H2O+O2+4e-====4OH-。
答案:A

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 溶液中;发生如下反应:
溶液中;发生如下反应: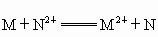 ,以下叙正确的是
,以下叙正确的是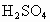 中,一定构成原电池,且N极上有
中,一定构成原电池,且N极上有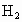 放出
放出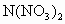 溶液中,一定构成原电池
溶液中,一定构成原电池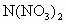 溶液中;发生如下反应:
溶液中;发生如下反应: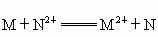 ,以下叙正确的是
,以下叙正确的是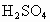 中,一定构成原电池,且N极上有
中,一定构成原电池,且N极上有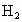 放出
放出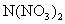 溶液中,一定构成原电池
溶液中,一定构成原电池