题目内容
18.硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等.(1)工业制硫酸铜的方法很多.
①方法一、用浓硫酸和铜制取硫酸铜.该反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如图1所示:

稀硫酸和氧化铁反应的离子方程式是Fe2O3+6H+═2Fe3++3H2O;铜和上述反应得到的物质反应的离子方程式是2Fe3++Cu═2Fe2++Cu2+;向混合溶液中通入热空气的反应的离子方程式是4Fe2++4H++O2═4Fe3++2H2O;分离蓝色滤液和红褐色沉淀的实验操作是过滤.
(2)氨法脱硫技术可吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵.主要的工艺流程如图2所示:
①吸收塔中发生反应的化学方程式是4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O.
②检验硫酸铵中的NH4+的离子方程式是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 (1)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
②依据流程图分析判断,稀硫酸、铜和氧化铁反应是氧化铁和稀硫酸反应生成硫酸铁和水,硫酸铁和铜反应生成氯化亚铁和氯化铜;通入热的空气是为了氧化亚铁离子为三价铁离子,调整溶液PH除去铁离子;溶液中得到溶质固体的方法是蒸发水结晶析出;
(2)①吸收硫酸工业尾气中的二氧化硫,同时制得硫酸铵,吸收塔中通入空气是利用氧气氧化二氧化硫为硫酸盐;
②检验铵根离子,可加入碱并加热,生成氨气,用检验氨气的方法检验.
解答 解:(1)①铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②依据流程转化图分析,铜需要硫酸和氧化铁反应生成的铁离子溶解生成铜离子,再通入空气氧化亚铁离子为铁离子,调节溶液PH使铁离子沉淀除去,得到硫酸铜溶液;加热蒸发浓缩结晶得到硫酸铜晶体;反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O、2Fe3++Cu═2Fe2++Cu2+(或Fe2O3+Cu+6H+═3H2O+2Fe2++Cu2+);通入空气的作用是氧气氧化亚铁离子为铁离子的反应,反应离子方程式为:4Fe2++4H++O2═4Fe3++2H2O;分离蓝色滤液和红褐色沉淀的实验操作是过滤,
故答案为:Fe2O3+6H+═2Fe3++3H2O;2Fe3++Cu═2Fe2++Cu2+;4Fe2++4H++O2═4Fe3++2H2O;过滤;
(2)①依据流程图分析,吸收塔中发生反应是二氧化硫、一水合氧气反应生成硫酸铵和水,反应的化学方程式为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;
故答案为:4NH3?H2O+2SO2+O2═2(NH4)2SO4+2H2O;
②检验铵根离子,可加入碱并加热,生成氨气,用检验氨气的方法检验,涉及到的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查了制备方案的设计,题目难度中等,根据制备流程明确制备原理为解答关键,注意掌握制备方案设计与评价的原则,试题培养了学生的分析能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、SO32-、ClO- | ||
| C. | K+、NO3-、Fe2+、H+ | D. | Mg2+、NH4+、Cl-、SO42- |
①铵盐中氮元素化合价都是-3价;
②铵盐都是晶体,都易溶于水;
③铵盐与碱共热放出氨气;
④铵盐都不能与酸反应;
⑤铵盐都易分解.
其中正确的是( )
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②③⑤ |
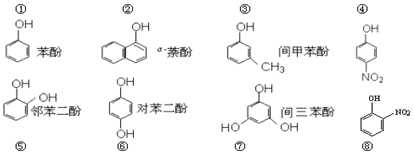
⑨HNO3 ⑩NH3.
| A. | 能形成分子内氢键的有⑤⑧⑨ | |
| B. | 能形成分子间氢键有①②③④⑥⑦⑩ | |
| C. | 根据氢键形成的条件,可以推测还有元素Li的原子可以代替氢原子而形成类似氢键的结构 | |
| D. | C2H6O分子中同时存在极性键、非极性键和氢键 |
| A. | X可以是淀粉或纤维素 | |
| B. | Y→乙醛属于消去反应 | |
| C. | Y与CH3OCH3是同分异构体 | |
| D. | 利用FeCl3溶液鉴别苯酚溶液和Y溶液 |
| A. | 渗析实验可以鉴别胶体和溶液 | |
| B. | 由分子组成的物质中一定存在共价键 | |
| C. | 水的电离是吸热过程,升高温度,水的离子积增大、pH减小 | |
| D. | 用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g) |
| A. | 2 L 氟化氢气体分解成 1 L 氢气与 1 L氟气吸收 270 kJ热量 | |
| B. | 1 mol氢气与 1 mol氟气反应生成 2 mol液态氟化氢放出的热量小于 270 kJ | |
| C. | 在相同条件下,1 molH2与 1 molF2的能量总和大于 2 molHF 气体的能量 | |
| D. | 1个氢气分子与 1 个氟气分子反应生成 2 个氟化氢气体分子放出 270 kJ热量 |
| A. | -688.3 kJ/mol | B. | -488.3 kJ/mol | C. | -191 kJ/mol | D. | +488.3 kJ/mol |