题目内容
有4.8g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28g,反应后全部气体用0.6mol/L Ba(OH)2溶液100mL吸收.下列有关叙述中正确的是
- A.原混合物中CuO与Fe2O3物质的量的比为1:1
- B.原混合物中CuO与Fe2O3的质量比为2:1
- C.吸收CO2后的溶液中一定有Ba(HCO3)2
- D.吸收CO2后的溶液中生成白色沉淀的质量为11.82 g
AC
分析:A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,根据n= 计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;
计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;
B、根据m=nM计算CuO、Fe2O3的质量,据此计算判断;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)= =0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;
=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;
D、令碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒列方程计算,再根据m=nM计算碳酸钡的质量.
解答:A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,混合物中氧原子的物质的量为 =0.08mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:
=0.08mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则: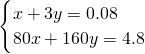 ,解得x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的比为0.02mol:0.02mol=l:l,故A正确;
,解得x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的比为0.02mol:0.02mol=l:l,故A正确;
B、原混合物中CuO、Fe2O3的质量之比为80g/mol×0.02mol:160g/mol×0.02mol=1:2,故B错误;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)= =0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故C正确;
=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故C正确;
D、令碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒,则: ,解得a=0.04,b=0.02,故生成碳酸钡的质量为0.04mol×197g/mol=7.88g,故D错误;
,解得a=0.04,b=0.02,故生成碳酸钡的质量为0.04mol×197g/mol=7.88g,故D错误;
故选AC.
点评:本题考查混合物的有关计算,难度中等,注意利用守恒思想进行的计算,注意判断二氧化碳与氢氧化钡反应的生成物.
分析:A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,根据n=
 计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;
计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;B、根据m=nM计算CuO、Fe2O3的质量,据此计算判断;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)=
 =0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;
=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡;D、令碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒列方程计算,再根据m=nM计算碳酸钡的质量.
解答:A、CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,混合物中氧原子的物质的量为
 =0.08mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:
=0.08mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则: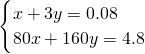 ,解得x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的比为0.02mol:0.02mol=l:l,故A正确;
,解得x=0.02、y=0.02,故原混合物中CuO与Fe2O3物质的量的比为0.02mol:0.02mol=l:l,故A正确;B、原混合物中CuO、Fe2O3的质量之比为80g/mol×0.02mol:160g/mol×0.02mol=1:2,故B错误;
C、CO获得1个O原子生成CO2,故n(CO2)=n(O)=
 =0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故C正确;
=0.08mol,n[Ba(OH)2]=0.6mol/L×0.1L=0.06mol,故n(CO2):n[Ba(OH)2]=0.08mol:0.06mol=4:3,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡,故C正确;D、令碳酸钡与碳酸氢钡物质的量分别为amol、bmol,根据钡离子守恒、碳元素守恒,则:
 ,解得a=0.04,b=0.02,故生成碳酸钡的质量为0.04mol×197g/mol=7.88g,故D错误;
,解得a=0.04,b=0.02,故生成碳酸钡的质量为0.04mol×197g/mol=7.88g,故D错误;故选AC.
点评:本题考查混合物的有关计算,难度中等,注意利用守恒思想进行的计算,注意判断二氧化碳与氢氧化钡反应的生成物.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目