题目内容
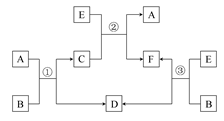
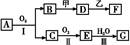
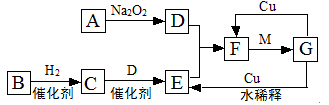
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:
(1) 写出反应②的化学反应方程式 ,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是 。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种无色的气体,且B遇盐酸产生无色无味的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是 。
(1)2Na2O2+2H2O=4NaOH+O2↑ (2分) 0.2mol(2分)
(2)Cl2+2NaOH=NaCl+NaClO+H2O(2分)
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O(2分)
NH3↑+CO32-+2H2O(2分)
(4)AlO2-+4H+=Al3++2H2O(2分)
解析试题分析:E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)设该反应转移电子的物质的量xmol
Na2O2+2H2O="4NaOH" + O2↑ 转移电子数
22.4L 2mol
2.24L x x=0.2mol,
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,A是氯气,与碱反应,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O
(3)B是一种酸式盐,且B遇盐酸有无色无味气体产生,所以B是碳酸氢盐, D是一种气体,强碱与酸式盐反应生成气体,该气体是氨气,所以A、B的反应是强碱和碳酸氢铵的反应,故答案为:2OH-+NH4++HCO3-=NH3↑+2H2O+CO32-
(4)B是一种含有两种金属元素的盐,所以B是偏铝酸钠,A是一种强酸,酸先和偏氯酸钠反应生成氢氧化铝,氢氧化铝和过量的酸反应生成铝离子,故答案为:AlO2-+4H+=Al3++2H2O.
考点:考查阿伏伽德罗常数、气体体积等相关知识。

 名校课堂系列答案
名校课堂系列答案含某元素的物质间能实现如下直接转化,该元素是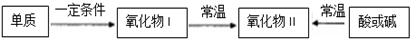
| A.碳 | B.氮 | C.硫 | D.钠 |