题目内容
4.下列关于铁制品腐蚀或保护措施的说法中不正确的有( )
| A. | 在如图所示环境中,铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ | |
| B. | 军事演习期间给坦克的履带上刷上油漆以防止生锈 | |
| C. | 在海轮的外壳上常焊有锌块,且定期更新 | |
| D. | 将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理 |
分析 A.原电池的负极金属的腐蚀速率>化学腐蚀速率>化学腐蚀;
B.履带上刷油漆不能防止生锈;
C.锌作负极,被腐蚀;
D.铁与氧气和水接触,所以能防止铁被腐蚀.
解答 解:A.I中Fe作负极被腐蚀,II中Fe作正极被保护,III中Fe主要是化学腐蚀,所以铁被腐蚀速率:Ⅰ>Ⅲ>Ⅱ,故A不选;
B.履带上刷油漆不能防止生锈,因为履带与地面不断摩擦,油漆不能附着在上面,故B选;
C.在海轮的外壳上常焊有锌块,锌作负极,被腐蚀,所以要定期更新,故C不选;
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理,阻止了铁与氧气和水接触,所以能防止铁被腐蚀,故D不选;
故选B.
点评 本题考查了金属的腐蚀与保护,题目难度不大,侧重于考查原电池原理的应用,注意把握金属防腐的原理和措施.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.以纯锌作阴极,以石墨作阳极,电解某浓度的硫酸锌溶液,阴极产物均附在电极上,通电一段时间后,关闭电源,迅速撤去电极(设阴极产物没有损耗),若在电解后的溶液中加入4.95g Zn(OH)2固体,则恰好能使溶液恢复到原浓度,则整个电解过程中,所产生的气体总体积为(标准状况)( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
15.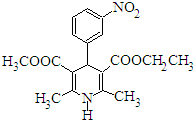 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
 尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )
尼群地平片可用于治疗高血压.其主要成分的结构简式如图所示.下列关于这种化合物的说法正确的是 ( )| A. | 该物质的分子式为C18H20N2O6 | |
| B. | 该物质可以和银氨溶液发生银镜反应 | |
| C. | 该物质属于芳香族化合物,能溶于水 | |
| D. | 该物质在酸性条件下不发生水解反应 |
12.将等质量的铜片在空气中加热后,分别插入下列溶液中,充分接触后,铜片质量减少的是( )
| A. | HNO3 | B. | 无水乙醇 | C. | 石灰水 | D. | 盐酸 |
9.2011年是国际化学年,中国的宣传口号是“化学--我们的生活,我们的未来”.下列有关叙述不正确的是( )
| A. | 提倡人们购物时不用塑料袋,是为了防止白色污染 | |
| B. | 利用太阳能、潮汐能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| D. | 大量排放SO2或CO2都会导致酸雨的形成 |
16. “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
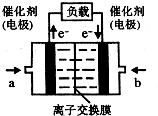
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.
 “温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(1)═C2H4(g)+3O2(g).△H=+1411.0kJ/mol
2CO2(g)+3H2O(1)═C2H5OH(1)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为C2H4(g)+H2O(1)═C2H5OH(1)△H=-44.2kJ/mol.
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
温度(K) CO2转化率(%) $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],CO2的转化率:增大(填“增大”“减小”“不变”).
②该反应的正反应为放热(填“吸”或“放”)热反应.
(3)一定条件下,将3molH2和lmolCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g). 2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是cd.
a.该条件下此反应的化学平衡常数表达式为k=$\frac{c(C{H}_{3}OH)•c({H}_{2}O)}{{c}^{3}({H}_{2})•c(C{O}_{2})}$
b.H2的平均反应速率为0.3mol/(L•s)
c.CO2的转化率为60%
d.混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是乙醇(填“乙醇”或“氧气”),b处电极上发生的电极反应是:O2+2H2O+4e-=4OH-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于5.6×10-5mo1/L.