题目内容
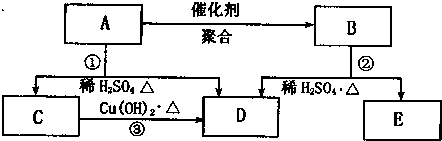
(2010?南昌一模)常温下甲为pH=2的醋酸溶液;乙为pH=2的醋酸和盐酸的混合液,等体积的甲乙两溶液相比,下列说法正确的是( )
分析:A、溶液PH都等于2,依据溶液中的离子积在常温下是常数得到氢氧根离子浓度相同;
B、醋酸是弱电解质,盐酸的存在抑制醋酸电离;
C、氯离子和醋酸根离子浓度都小于氢离子浓度;
D、醋酸是弱酸氢离子浓度越大,溶质浓度越大,消耗氢氧化钠越多;
B、醋酸是弱电解质,盐酸的存在抑制醋酸电离;
C、氯离子和醋酸根离子浓度都小于氢离子浓度;
D、醋酸是弱酸氢离子浓度越大,溶质浓度越大,消耗氢氧化钠越多;
解答:解:A、溶液PH都等于2,溶液中氢离子浓度都为0.02mol/L,依据溶液中的离子积在常温下是常数,氢氧根离子浓度相同,故A错误;
B、醋酸是弱电解质,盐酸的存在抑制醋酸电离,甲溶液中的醋酸根离子大于乙溶液中的醋酸根离子,故B正确
C、pH=2的醋酸和盐酸的混合液,氢离子浓度大于氯离子浓度,大于醋酸根离子浓度,故C错误;
D、PH=2的甲溶液和乙溶液中氢离子浓度相同,加入氢氧化钠溶液反应,醋酸是若电解质存在电离平衡,甲溶液浓度大于乙溶液中的醋酸浓度,所以加入相同浓度的NaOH溶液至中性,甲消耗氢氧化钠多,故D错误;
故选B.
B、醋酸是弱电解质,盐酸的存在抑制醋酸电离,甲溶液中的醋酸根离子大于乙溶液中的醋酸根离子,故B正确
C、pH=2的醋酸和盐酸的混合液,氢离子浓度大于氯离子浓度,大于醋酸根离子浓度,故C错误;
D、PH=2的甲溶液和乙溶液中氢离子浓度相同,加入氢氧化钠溶液反应,醋酸是若电解质存在电离平衡,甲溶液浓度大于乙溶液中的醋酸浓度,所以加入相同浓度的NaOH溶液至中性,甲消耗氢氧化钠多,故D错误;
故选B.
点评:本题考查了弱电解质的电离平衡,溶液PH计算,溶液中离子浓度大小比较,关键是理解电离平衡微弱,影响电离平衡的因素应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
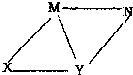 (2010?南昌一模)现有HCl,Ba(OH)2,Na2CO3,NaHCO3四种物质的澄清溶液,它们之间有如图所示的反应关系,图中每条线两端的物质均可相互反应,下列推断正确的是( )
(2010?南昌一模)现有HCl,Ba(OH)2,Na2CO3,NaHCO3四种物质的澄清溶液,它们之间有如图所示的反应关系,图中每条线两端的物质均可相互反应,下列推断正确的是( )