题目内容
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义.
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如图所示.
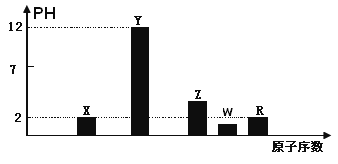
(1)元素R在周期表中的位置是
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(3)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
Ⅱ.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:

已知A是一种正盐,则反应I的化学反应方程式为
【答案】I.(1)第三周期第ⅦA族
(2)离子键、非极性共价键
(3)H++NH3=NH4+
II.(1)AC(2)![]() ;②COS+4NaOH=Na2S+Na2CO3+2H2O
;②COS+4NaOH=Na2S+Na2CO3+2H2O
【解析】试题分析:I.由题意X、Y、Z、W、R是短周期主族元素且原子序数依次增大,最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH,Y对应PH=12,说明Y是钠,X对应PH=2,X是氮,Z对应PH>2,所以Z是磷,W对应PH<2,所以W是S;R对应PH=2原子序数最大,所以R是Cl。
(1)元素R在周期表中的位置是:第三周期第ⅦA族。
(2)元素Y和W形成的Y2W2型化合物是Na2S2中含有化学键的类型为:离子键、非极性共
价键。
(3)X为N元素,其最高价氧化物对应的水化物与其气态氢化物的离子反应方程式为:H++
NH3 = NH4+。
II.(1)A.元素的非金属性越强,与氢气化合越容易。S与H2发生化合反应比C与H2化合更容易,则能说明碳与硫两元素非金属性相对强弱关系为:S>C,故A正确;B.酸性:H2SO3>H2CO3,亚硫酸不是最高价含氧酸,不能说明碳与硫两元素非金属性相对强弱,故B错误;C.直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故C正确。故答案为:AC;
(2)由流程可知,COS与氢氧化钠反应,根据原子守恒,A溶液应该是含C的正盐,所以A为Na2CO3;硫化钠溶液加热生成Na2S2O3和气体,由原子守恒,气体a应该是氢气。
①羰基硫(COS)的电子式为![]() 。故答案为:
。故答案为:![]() ;
;
②由上述分析可知,A是Na2CO3;则反应I的化学反应方程式为:COS +4NaOH =Na2S + Na2CO3+2H2O。

【题目】具有中间价态的物质既可被氧化又可被还原,下表中的内容有错误的是
选项 | 具有中间价态的物质 | 还原产物 | 氧化产物 |
A | Fe2+ | Fe | Fe3+ |
B | SO32- | S | SO42- |
C | H2O2 | H2O | O2 |
D | N2 | NH3 | N2H4 |
A. A B. B C. C D. D