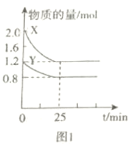
题目内容
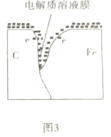
【题目】某原电池的结构如图所示,下列有关该原电池的说法正确的是
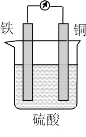
A. 该电池工作时电能转变为化学能 B. 铜片的质量增加
C. H+向铁片移动 D. 铁片上发生的反应是Fe-2e-=Fe2+
【答案】D
【解析】
该装置中,活动性强的Fe易失电子作负极,活动性弱的铜作正极,在负极上电极失电子发生氧化反应,在正极上溶液中的阳离子得电子发生还原反应,溶液中阳离子向正极移动,阴离子向正极移动,据此解答。
A.该装置为原电池,原电池工作时把化学能转化为电能,A错误;
B.铜作正极,正极上H+得电子生成H2逸出,所以铜片的质量不变,B错误;
C.溶液中阳离子向负电荷较多的正极移动,所以H+向铜片移动,C错误;
D.Fe易失电子作负极,铁片上发生的反应是Fe-2e-=Fe2+,D正确;
故合理选项是D。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
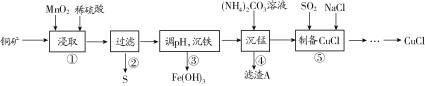
轻松课堂标准练系列答案【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。