题目内容
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的电子排布式为______________________。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比________。

(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________。
【答案】C<O<N 1s22s22p63s23p63d104s1或 [Ar]3d104s1 sp2 平面三角形 2NA(或2×6.02×1023) 1∶5 5 0.083 g·cm-3
【解析】
A、B、C、D都是前36号元素,它们的核电荷数依次增大,第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则原子核外电子排布为1s22s23p2,故A为C元素;C是地壳中含量最高的元素,所以C是O元素;B原子的最外层p轨道的电子为半满结构,最外层电子排布为2s22p3,故B为N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,故D元素原子各层电子数分别为2、8、18、1,是29号Cu元素。
(1)C、N、O元素是同一周期元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N。D的原子序数是29,为Cu元素,其原子核外电子排布式为:1s22s22p63s23p63d104s1。本小题答案为:C<O<N;1s22s22p63s23p63d104s1。
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式为sp2,NO3-中N原子形成3个δ键,孤电子对![]() ,则应为平面三角形。本小题答案是为:sp2;平面三角形。
,则应为平面三角形。本小题答案是为:sp2;平面三角形。
(3)将CN-中C原子及1个负电荷换成1个N原子,可得到等电子体N2,CN-中形成C≡N三键,1个CN-含有2个π键,故1molCN-中含有的π键个数为2NA。本小题答案为:2NA(或2×6.02×1023)。
(4)由晶胞结构可以知道,Ca原子处于顶点,晶胞中含有Ca原子数目为![]() ,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为
,Cu原子处于晶胞内部与面上、面心,晶胞中Cu数目为![]() ,故该合金中Ca和Cu的原子个数比为1:5。本小题答案为:1∶5。
,故该合金中Ca和Cu的原子个数比为1:5。本小题答案为:1∶5。
(5)由(4)知n=5,晶胞中拥有4.5个H原子,氢在合金中的密度为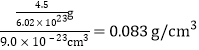 。本小题答案为:5;0.083g/cm3。
。本小题答案为:5;0.083g/cm3。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
I.已知某些化学键的键能数据如下
化学键 | C=O | C—O | C—H | H—H | O—H |
键能/kJ·mol-1 | 745 | 351 | 415 | 436 | 462 |
则CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
CH3OH(g) + H2O(g) ΔH = __________ kJ·mol-1
II.将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
(1)该反应化学平衡常数表达式K = __________。
(2)已知在某压强下,该反应在不同温度、不同投料比时,达平衡时CO2的转化率如图所示:

①该反应的ΔH __________ 0(填“>"或“<”)。
②若温度不变,减小反应投料比[n(H2)/n(CO2)],K值将____(填“增大”、“减小”或“不变”)。
(3)某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,下列物理量不再发生变化时,能说明反应达到平衡状态的是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(4)某温度下,在体积可变的密闭容器中,改变起始时加入各物质的量,在不同的压强下,平衡时CH3OCH3(g)的物质的量如下表所示:
P1 | P2 | P3 | |
I.2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II.1.0 mol CO22 | X1 | Y1 | Z1 |
III.1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
①P1 __________ P3(填“>”“<”或“=”);
②P2下,III中CH3OCH3的平衡转化率为__________。
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:

已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)


