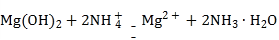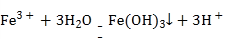题目内容
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是:
H++A-,下列叙述不正确的是:
A. 溶液中离子浓度的关系满足:c(H+) = c(OH-)+c(A-)
B. 常温下,加入NaA固体可使HA的电离常数增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 0.10mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
【答案】B
【解析】
A.溶液呈电中性,阴阳离子所带电荷相等,根据电荷守恒得:c(H+)=c(OH-)+c(A-),故A正确;
B.温度不变,弱酸的电离平衡常数不变,故B错误;
C.加入少量的NaA时,c(A-)增大,从而抑制弱酸电离,平衡逆向移动,故C正确;
D.加水稀释促进弱电解质电离,氢离子浓度减小,水的离子积常数不变,所以c(OH-)增大,故D正确。
故选B。

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
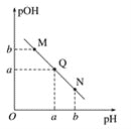
【题目】将2.7g铝溶解于100mL 3 mol·L-1 NaOH溶液中,然后向所得溶液中加入400mL 1 mol·L-1盐酸,最后可得沉淀的质量是()
A.2.7gB.5.2gC.7.8gD.10g
【题目】下列离子方程式能用来解释相应实验现象的是
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
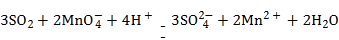
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D