题目内容
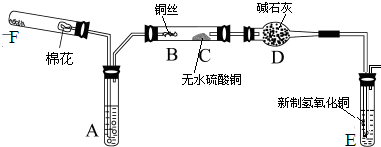
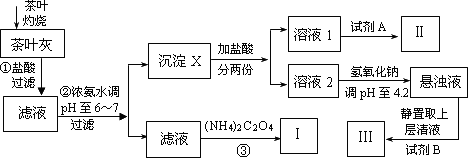
某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.
已知Ca2+、Al3+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是________.
(2)步骤②中调节pH至6~7的目的是________.
(3)沉淀X所含主要物质的化学式为________.
(4)写出步骤③中发生反应的离子方程式:________.
(5)试剂A为________;试剂B为铝试剂,加入该试剂后的实验现象是________.

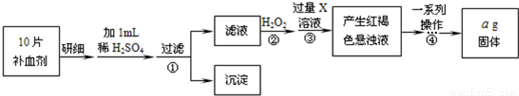
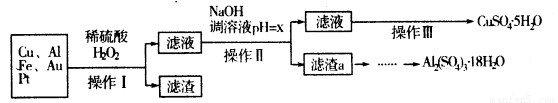
下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
开始沉淀 | 1.1 | 4.0 | 5.4 |
完全沉淀 | 3.2 | 5.2 | 6.7 |
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:????????????? .。
(2)在操作Ⅱ中,x的取值范围是???????????? ? 。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有??????????? 。
(4)由滤渣a制取Al2(SO4)3·l8H2O,探究小组设计了三种方案:
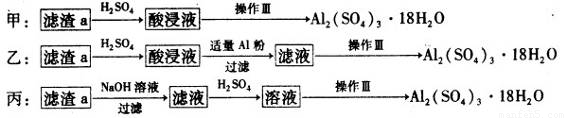
综合考虑上述三种方案,最具可行性的是?????? (填序号)。
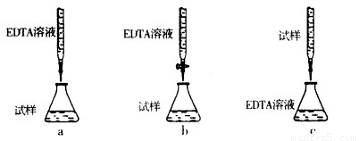
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 ?????????? 。
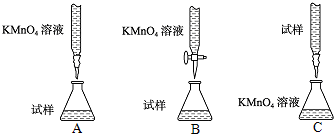
②下列滴定方式中,最合理的是(夹持部分略去) ??????????? (填序号)。