题目内容
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
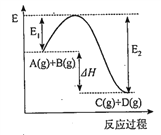
(1)该反应是___________反应(填“吸热”或“放热”)。
(2)△H=_______________。
(3)反应体系中加入催化剂对反应热是否有影响?___________________(填“有影响”“无影响”)。
(4)升高温度,该反应的平衡常数K将_________(填“增大”“减小”或“不变”)。
【答案】 放热 -(E2-E1)或E1﹣E2 无影响 减小
【解析】(1)由图像可得反应物总能量大于生成物的总能量,则该反应的正向为放热反应。
(2)该反应的正向为放热反应,则△H<0,由图像所示数据得△H=-(E2-E1)或E1﹣E2。
(3)催化剂能加快反应速率但不改变化学平衡状态,对化学平衡没有影响,所以加入催化剂对反应热无影响。
(4)该反应的正向为放热反应,升高温度,该反应的平衡常数K将减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
【题目】实验室从海带中提取碘的操作过程中,仪器选用不正确的是 ( )
选项 | A | B | C | D |
操作 | 称取3g左右的剪碎了的干海带 | 灼烧干海带碎片至完全变成灰烬 | 过滤煮沸后的海带灰与水的混合液 | 用四氯化碳从氧化后的海带灰浸取液中提取碘 |
选用仪器 | 托盘天平 | 蒸发皿 | 普通漏斗 | 分液漏斗 |
A. A B. B C. C D. D

