题目内容
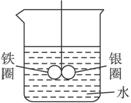
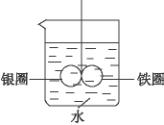
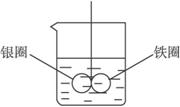
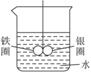
如下图所示的装置:在盛有水的烧杯中,在铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入硫酸铜溶液.
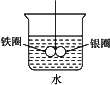
(1)片刻后可观察到的现象是(指悬吊的金属圈)________
A.铁圈和银圈左右摇摆不定
B.保持平衡状态不变
C.铁圈向下倾斜
D.银圈向下倾斜
(2)产生上述现象的原因是________.
答案:
解析:
解析:
|
答案:(1)D (2)加入硫酸铜溶液后,构成FeAg原电池,Fe溶解,减轻,Cu2+在银圈上得到电子,沉积在其上,增重,所以银圈向下倾斜.该装置是一个铁为负极,银为正极,硫酸铜溶液为电解质溶液的原电池. 解析:滴入硫酸铜溶液后,铁作为原电池的负极被氧化而溶解:Fe-2e- |

练习册系列答案
 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目