题目内容
下列变化为放热的化学反应的是


| A.H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1 |
| B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1 |
| C.形成化学键时共放出862 kJ能量的化学反应 |
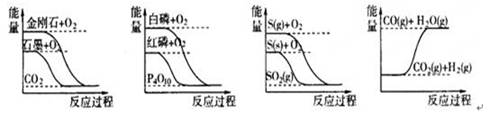
| D.能量变化如右图所示的化学反应 |
D
试题分析:A、状态变化,不是化学反应,故A错误;B、ΔH>0,为吸热反应,故B错误;C、只知道形成化学键时放出的热量,不知道断裂化学键时吸收的能量,不能判断是吸热反应还是放热反应,故C错误;D、反应物的总能量大于生成物的总能量,故为放热反应,故D正确;故选D。

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目