题目内容
【题目】
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是________。
(2)根据元素周期律,电负性Se________S,第一电离能Se________As(填“>”或“<”)。
(3)H2S分子的电子式:________,H2Se分子构型是_______,
其中硒原子的杂化轨道类型是________。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________。
(5)晶体Zn为六方最密堆积,其配位数是________。
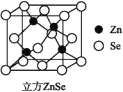
(6)ZnSe晶胞如图,假设阿伏加德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是________。
【答案】 3d104s2 < < ![]() V形 sp3 水分子间存在氢键、H2Se分子间无氢键 12
V形 sp3 水分子间存在氢键、H2Se分子间无氢键 12 ![]()
【解析】(1)本题考查价电子和排布式,Zn位于第四周期IIB族,价电子包括最外层电子和次外层d能级,排布式为3d104s2;(2)考查电负性规律和第一电离能规律,非金属性越强,电负性越强,同主族从上到下非金属性越弱,即电负性:SeA>IIA,VA>VIA,因此第一电离能:Se2S的电子式为:![]() ,H2Se中心原子Se有2个σ键,孤电子对数为(6-2×1)/2=2,分子构型为V型;(4)考查分子间氢键对物质物理性质的影响,H2O中存在分子间氢键,H2Se不存在分子间氢键,因此H2O的熔沸点高于H2Se;(5)考查金属晶体堆积方式,Zn是六方最密堆积,其配位数为12;(6)考查晶胞的计算,根据晶胞的结构,Zn位于内部,Se位于顶点和面心,因此1个晶胞中含有4个ZnSe,其质量为
,H2Se中心原子Se有2个σ键,孤电子对数为(6-2×1)/2=2,分子构型为V型;(4)考查分子间氢键对物质物理性质的影响,H2O中存在分子间氢键,H2Se不存在分子间氢键,因此H2O的熔沸点高于H2Se;(5)考查金属晶体堆积方式,Zn是六方最密堆积,其配位数为12;(6)考查晶胞的计算,根据晶胞的结构,Zn位于内部,Se位于顶点和面心,因此1个晶胞中含有4个ZnSe,其质量为![]() ,因此144gZnSe含有晶胞的个数为
,因此144gZnSe含有晶胞的个数为![]() 。
。

【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是:CuFeS2+4Fe3+=Cu2++5Fe2++2S
(1)上述总反应的原理如图1所示。正极的电极反应式是_______________________________。
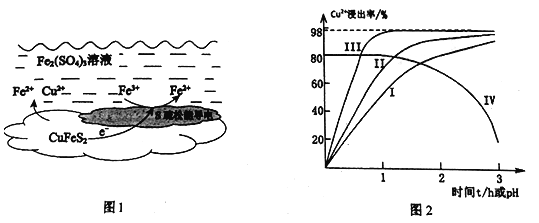
(2)一定温度下,控制浸取剂pH=1,总体积为1L,取三份相同质量黄铜矿粉末分别进行实验,结果如图2:
实验 | 操作 |
I | 加入足量0.100 molL-1Fe2(SO4)3溶液 |
II | 加入足量0.100 molL-1Fe2(SO4)3溶液,通入空气 |
Ⅲ | 加入足量0.100 molL-1Fe2(SO4)3溶液,再加入少量 0.000500 molL-1Ag2SO4溶液 |
①曲线IV是在实验I的基础上改变溶液的pH所得实验结果,请分析pH从2到3,Cu2+浸出率明显下降的原因____________________________(用离子方程式描述)。
②对比实验I、Ⅱ,通入空气,Cu2+浸出率提髙的原因是_________________________。
③由实验Ⅲ推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
i . CuFeS2+4Ag+=Fe2++Cu2++2Ag2S
ii.……
写出上述ii的离子方程式_____________________________________________。
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005mol·L-lAg2SO4溶液,充分混合后静置。取上层淸液,加入稀盐酸,观察到溶液中_______________________,证明发生反应i
b.取少量Ag2S粉末,加入________________溶液,充分混合后静置。取上层淸液,加入稀盐酸,有白色沉淀,证明发生反应ii
④若实验中样品含铜a mol,则实验I的平衡常数K=_____________(杂质不参与反应,只要求列出计算式,不必算出结果)。
(3)为了进一步研究上述实验Ⅲ结论的可靠性,査得资料Ksp(Ag2S)=6.4×10-50,Ksp(AgCl)=1.8×10-10,试计算,使饱和Ag2S溶液中的Ag+开始转化为AgCl沉淀所需盐酸的最低浓度为____________ mol/L (己知![]() ≈2.5)。
≈2.5)。