题目内容
H2O2是实验室常用的一种化学试剂。某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)实验①和②的目的是_ ,
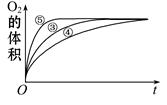
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。
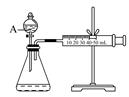
(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。
(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol·L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol·L-1FeCl3溶液 |
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图。分析下图能够得出的结论是 。

(3)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学设计了如下图所示的实验装置进行实验。
实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,则实验中需要测量的数是 。

(4)H2O2能氧化H2SO4 酸化的FeSO4,离子方程式为 ;
(8分)(1)探究H2O2溶液的浓度的变化对分解速率的影响。
(2)图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)Fe2++2H2O2+4H+= Fe3++4H2O
(2)图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)Fe2++2H2O2+4H+= Fe3++4H2O
试题分析:(1)根据表中数据可知,实验①②中不同之处在于双氧水的浓度不同,所以实验目的是探究H2O2溶液的浓度的变化对分解速率的影响。
(2)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,即实验结论是图像显示FeCl3溶液的催化作用,碱性条件下效果较好,酸性条件下效果较弱。
(3)要比较Fe3+和Cu2+对H2O2分解的催化效果,应在相同的条件下利用一个变量来比较,同时还需要测量测量出分别在Fe3+和Cu2+的催化作用下,收集40mL气体的始、终时间,就能计算出反应速率。
(4)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是Fe2++2H2O2+4H+=Fe3++4H2O。
点点评:该题是中等难度的试题,试题综合性强,侧重对学生实验探究能力的培养,有利于激发学生的学习积极性,也有助于培养学生的规范实验设计能力。所以该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该题能较好的考查学生实验设计、数据处理、图象分析的综合能力。在解答时注意已知信息的利用。

练习册系列答案
相关题目
 N2O4,测得NO2转化率为a%,在温度、体积不变时,再通入1mol NO2,待重新建立平衡时,测得NO2转化率为b%,a与b比较( )
N2O4,测得NO2转化率为a%,在温度、体积不变时,再通入1mol NO2,待重新建立平衡时,测得NO2转化率为b%,a与b比较( )