题目内容
(9分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。
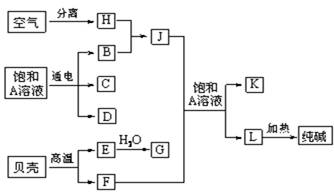
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式: 。
(2) 电解A溶液反应的离子方程式为___________________________。
若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为 L
(3) J分子的空间构型为______________________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:_______________________________________。
(9分)(1)2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O (2分)
(2)2H2O+2Cl- Cl2↑+H2↑+2OH- 89.6L
(4分)
Cl2↑+H2↑+2OH- 89.6L
(4分)
(3) 三角锥 (1分)
(4) Ca(OH)2+2NH4Cl  CaCl2+2NH3↑+2H2O
(2分)
CaCl2+2NH3↑+2H2O
(2分)
【解析】本题是无机框图题,关键是找准突破点。贝壳的主要成分是碳酸钙,高温下分解生成氧化钙和CO2。由于海水中含有氯化钠,且 C和D、C和G反应都可以制取消毒剂,这说明C是氯气,D是氢氧化钠,B是氢气,而A是氯化钠。J与CO2通入饱和氯化钠溶液中能得到L,而L加热即生成碳酸钠,说明L是碳酸氢钠,因此该反应式侯氏制碱法的原理,即J是氨气,则H是氮气,K是氯化铵。
(1)氯气和氢氧化钙反应生成漂白粉的方程式是2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O。
(2)工业电解饱和食盐水的方程式是2H2O+2Cl- Cl2↑+H2↑+2OH-。关键方程式可知,反应中转移2个电子,所以如果转移8NA个电子,则生成氢气和氯气各是4mol,在标准状况下的体积是4mol×22.4L/mol=89.6L。
Cl2↑+H2↑+2OH-。关键方程式可知,反应中转移2个电子,所以如果转移8NA个电子,则生成氢气和氯气各是4mol,在标准状况下的体积是4mol×22.4L/mol=89.6L。
(3)氨气是三角锥形结构。
(4)实验室制取氨气的方程式是Ca(OH)2+2NH4Cl
 CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

