题目内容
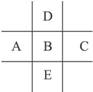
下图为周期表的一部分,已知A、B、C、D、E共有85个电子,E原子核外有4个电子层,则B元素是( )
A.P B.Mg C.Cl D.Si
解析:由于E是第4周期元素,且A、B、E处于同一主族。根据这五种元素的排列情况,A、B、E只能处于ⅡA到ⅦA族。若它们处于ⅡA族,设B的原子序数为x则A、E、C、D的原子序数依次为x-8、x+8、x-1、x+1。根据题给条件可知5x=85,则x=17,B为氯,A、C、D、E依次为F、S、Ar、Br。但这五种元素的核外电子数之和,也就是原子序数之和大于85,因此与题给条件不符。若A、B、E为ⅢA到ⅦA族元素,设B的原子序数为x,则A、E、C、D的原子序数依次为x-8、x+18、x-1、x+1,5x+10=85,则x=15,B为磷,则A、C、D、E依次为N、Si、S、As元素,符合题意。故正确选项为A。
答案:A

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
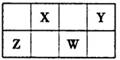
X、Y、Z、W均为短周期主族元素,下图为周期表的一部分。下列说法正确的是
| A.通常情况下,X元素只存在两种氧化物 |
| B.Y元素气态氢化物的还原性最强 |
| C.X元素的非金属性比Y元素非金属性强 |
| D.Z和X可能以共价键结合形成一种无机非金属材料 |