题目内容
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
【1】硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式____________。
【2】向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象。____
【3】为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质是_______。
的比值变小,可适量加入(或通入)的物质是_______。
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物____________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与______________有关。
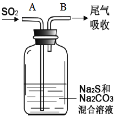
【4】在如图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)________ H2S,原因是__________。
【5】常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
温度(℃) | c(氨水)(mol/L) | 电离程度(%) | c(OH-)(mol/L) |
0 | 16.56 | 9.098 | 1.507×10-2 |
10 | 15.16 | 10.18 | 1.543×10-2 |
20 | 13.63 | 11.2 | 1.527×10-2 |
表中c(OH-)基本不变的原因是________。
【答案】
【1】3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O
【2】饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成
【3】 d 不同 浓度
【4】 不含 H2S会与SO2反应,生成S沉淀
【5】氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变
【解析】
1.在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,书写化学方程式时,由于不能确定硫酸在反应物还是生成物中出现,所以最后配平时再考虑。
2.向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,说明c(S2-)小,继续滴加一定量的氨水后,生成ZnS沉淀,说明平衡移动后,使c(S2-)增大。
3.为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
向Na2S固体中分别加入浓硫酸时,发生氧化还原反应,加入稀硫酸时,发生复分解反应,由此可确定反应产物及硫酸表现性质的异同。
4.在如图中,从A管通入一定量SO2后,SO2与H2S的氧化还原反应先进行,SO2与Na2CO3的非氧化还原反应后发生。
5.对于弱电解质的电离,浓度小,电离程度大,温度高,电离程度大;所以,分析c(OH-),也应从两个方面考虑。
【1】在酸性条件下,H2S和KMnO4反应生成S、MnSO4、K2SO4和H2O,书写化学方程式时,先按电子守恒配平5H2S+2KMnO4→5S↓+2MnSO4,再按质量守恒配平得方程式3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O。答案为:3H2SO4+5H2S+2KMnO4→5S↓+2MnSO4+K2SO4+8H2O;
【2】向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,说明c(S2-)小,继续滴加一定量的氨水后,生成ZnS沉淀,说明平衡移动后,使c(S2-)增大。用电离平衡原理解释为:饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成。答案为:饱和H2S溶液中电离产生的S2-很少,因此没有沉淀,加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成;
【3】为了使Na2S溶液中![]() 的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
的比值变小,可适量加入(或通入)的物质,要么直接加入S2-,要么设法抑制S2-的水解。
a.通入H2S气体,发生反应S2-+H2S=2HS-,c(S2-)减小,![]() 增大,a不合题意;
增大,a不合题意;
b.加入NaOH固体,虽然抑制S2-水解,增大c(S2-),但同时加入Na+,c(Na+)增大更多,所以![]() 增大,b不合题意;
增大,b不合题意;
c.通入HCl气体,发生反应S2-+2H+=H2S↑,c(S2-)减小,![]() 增大,c不合题意;
增大,c不合题意;
d.加入KOH固体,抑制S2-水解,c(S2-)增大,![]() 减小,d符合题意;
减小,d符合题意;
故选d。
向Na2S固体中分别加入浓硫酸时,发生氧化还原反应,加入稀硫酸时,发生复分解反应,所得产物不同,由此可知硫酸氧化性的强弱与浓度有关。
答案为:d;不同;浓度;
【4】4.从A管通入一定量SO2后,发生反应:3SO2+2Na2S=2Na2SO3+3S↓,SO2+Na2CO3=Na2SO3+CO2,所以B处排出的气体中不含 H2S,原因是H2S会与SO2反应,生成S沉淀。答案为:不含;H2S会与SO2反应,生成S沉淀;
【5】对于弱电解质的电离,浓度小,c(OH-)小,温度高,电离程度大,c(OH-)大。由此得出表中c(OH-)基本不变的原因是氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变。答案为:氨水浓度降低,使c(OH-)减小,而温度升高,使c(OH-)增大,双重作用使c(OH-)基本不变。
往Na2S溶液中加入NaOH固体,由于我们的注意力主要集中在OH-的加入,抑制S2-的水解,从而导致c(S2-)增大,很容易得出结论:![]() 增大,所以,在解题时,应先看加入后,直接引起的浓度变化,然后再看对平衡的影响。
增大,所以,在解题时,应先看加入后,直接引起的浓度变化,然后再看对平衡的影响。

【题目】下列实验中的颜色变化,与氧化还原反应无关的是
A | B | C | D | |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | Na2S溶液滴入AgCl浊液中 | 热铜丝插入稀硝酸中 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 沉淀由白色逐渐变为黑色 | 产生无色气体,随后变为红棕色 |
A. A B. B C. C D. D