题目内容
【题目】关于化合物![]() 的结构简式如图
的结构简式如图![]() 的说法正确的是
的说法正确的是
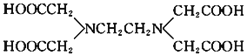
A.![]() 中所含的化学键有离子键、共价键、配位键和氢键
中所含的化学键有离子键、共价键、配位键和氢键
B.EDTA中碳原子的杂化轨道类型为![]() 、
、![]()
C.![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]()
D.![]() 与
与![]() 互为等电子体,但空间构型不同
互为等电子体,但空间构型不同
【答案】B
【解析】
本题考查化学键类型、杂化方式、第一电离能和等电子体的判断,运用化学键类型、杂化方式、第一电离能和等电子体的判断方法分析。
A.![]() 中所含的化学键有硫酸根离子与配离子之间是离子键,硫酸根离子、EDTA内部是共价键,EDTA与铜离子之间是配位键,氢键不属于化学键,故A错误;
中所含的化学键有硫酸根离子与配离子之间是离子键,硫酸根离子、EDTA内部是共价键,EDTA与铜离子之间是配位键,氢键不属于化学键,故A错误;
B.EDTA中有6个“—CH2—”和4个“—COOH”,“—CH2—”中碳原子为![]() 杂化,“—COOH”中碳原子为
杂化,“—COOH”中碳原子为![]() 杂化,所以EDTA中碳原子的杂化轨道类型为
杂化,所以EDTA中碳原子的杂化轨道类型为![]() 、
、![]() ,故B正确;
,故B正确;
C.同一主族中,从上向下,元素第一电离能逐渐减小,同一周期中,元素的第一电离能随着原子序数的增大呈增大趋势,但N原子最外层的2p能级处于半满状态,是一种较稳定结构,所以它的第一电离能高于同周期相邻的元素,![]()
![]() 的组成元素的第一电离能顺序为
的组成元素的第一电离能顺序为![]() ,故C错误;
,故C错误;
D.![]() 中S原子价层电子对数
中S原子价层电子对数![]() ,没有孤电子对,故
,没有孤电子对,故![]() 为正四面体结构,
为正四面体结构,![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 也正四面体结构,故D错误;
也正四面体结构,故D错误;
答案选B。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D



