题目内容
乙醇燃料电池中采用磺酸类质子溶剂,在200 ℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,错误的是
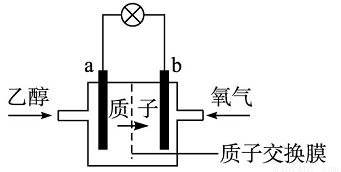
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O-8e-=2CO2+12H+
D.b极上发生的电极反应是4H++O2+4e-=2H2O
练习册系列答案
相关题目
参考下列图表和有关要求回答问题。
(1)图Ⅰ是1 mol NO2(g)和1 molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________,ΔH的变化是________(填“增大”“减小”或“不变”)。请写出NO2和CO反应的热化学方程式____________________;
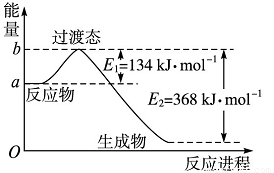
图Ⅰ
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇完全燃烧的热化学方程式为________________________;
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | a | b | c | x |
已知白磷的标准燃烧热ΔH为-d kJ·mol-1,白磷及其完全燃烧的产物结构如图Ⅱ所示,则上表中x=__________kJ·mol-1(用含有a、b、c、d的代数式表示)。

图Ⅱ


 H++A2-。回答下列问题:
H++A2-。回答下列问题: H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。 CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。 =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。 制成溶液时放出热量为Q1,又知胆矾分解的热化学方程式为CuSO4·5H2O(s)
制成溶液时放出热量为Q1,又知胆矾分解的热化学方程式为CuSO4·5H2O(s)  CuSO4(s)+5H2O(l) ΔH=+Q2,则Q1和Q2的关系为
CuSO4(s)+5H2O(l) ΔH=+Q2,则Q1和Q2的关系为
 H=+0.33 kJ·mol-1
H=+0.33 kJ·mol-1