题目内容
利用下图进行实验,下列实验结果能说明结论的是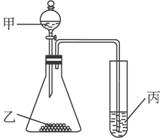
A.甲:浓硝酸,乙:铜,丙:硫化钾溶液。
证明氧化性:HNO3>Cu2+>S
B.甲:盐酸,乙:硫化亚铁,丙:溴水。
证明还原性:S2->Br->Cl-
C.甲:水,乙:电石,丙:溴水。
证明稳定性:H2O>C2H2>Br2
D.甲:盐酸,乙:石灰石,丙:苯酚钠溶液。
证明酸性:盐酸>H2CO3>C6H5OH
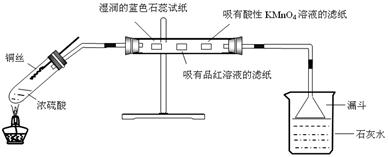
D 由装置图可知,进入丙试管的物质必须为气体。A中锥形瓶内产生的铜离子在溶液中,故A错;B中锥形瓶内产生的是硫化氢气体,没有涉及氯气,故B错;C中锥形瓶内产生的是乙炔气体,只是能与溴发生加成反应,故C错;D中锥形瓶内产生的是二氧化碳气体,能与苯酚钠溶液反应产生苯酚,故D正确。

实验一:甲同学利用Al、Fe、Mg和2 mol·L-1的稀硫酸,设计实验方案研究影响反应速率的因素。
研究的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是________________________;要得出正确的实验结论,还需控制的实验条件是________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验。用大小形状相同的Fe分别和0.5 mol·L-1及2 mol·L-1的足量稀硫酸反应。通过______________可以说明浓度对化学反应速率的影响。

实验二:已知2KMnO4+5H![]() K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,可以在反应一开始时加入____________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水