题目内容
(8分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。
请根据图示回答下列问题:
(1)图中a电极是 (填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L 氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量
是 mol。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26 kJ,写出甲醇燃烧的热化学方程式: 。
(8分)(1)阳极 4 OH–-4 e–→O2+2H2O
(2)CH3OH-6e– +8OH–→CO32— + 6H2O
(3)0.45
![]() (4)CH3OH(l)+ 3/2O2(g) CO2(g)+ 2H2O(l) △H1 = –726.52 kJ/mol
(4)CH3OH(l)+ 3/2O2(g) CO2(g)+ 2H2O(l) △H1 = –726.52 kJ/mol
(合理给分)
注:除注明分值外的题为每空2分
解析:

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。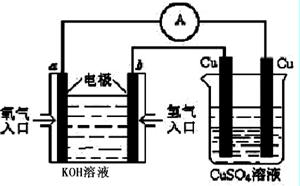
 H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
