题目内容
下列说法中,正确的是:
| A.0.1 mol·L-1的醋酸溶液加水稀释,c(H+)、c(OH-)同比例减小 |
| B.体积相同、pH相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 |
| C.将nmol H2(g)、n mol I2(g)和2n mol H2 (g)、2n mol I2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 |
| D.室温下,某溶液中由水电离的出H+浓度为10-amol/L,a<7时,溶液的pH为a或14 -a |
选B
 A项,稀释醋酸溶液,c(H+)、c(OH-)同时减小,由于醋酸电离度的增大,平衡右移,n(H+)增大,c(H+)的减小程度小于c(OH-),A不正确。B项,锌粉加入NH4Cl溶液中,对NH4+的水解起到促进作用,平衡右移,c(H+)增大,所以锌粉用量小于盐酸,B正确。C项,H2(g)+ I2(g) 2HI(g),是一个反应前后气体体积不变的反应,在恒温恒压条件下,这两组建立一个等效平衡,所以H2的转化率一样,所以C不正确。
A项,稀释醋酸溶液,c(H+)、c(OH-)同时减小,由于醋酸电离度的增大,平衡右移,n(H+)增大,c(H+)的减小程度小于c(OH-),A不正确。B项,锌粉加入NH4Cl溶液中,对NH4+的水解起到促进作用,平衡右移,c(H+)增大,所以锌粉用量小于盐酸,B正确。C项,H2(g)+ I2(g) 2HI(g),是一个反应前后气体体积不变的反应,在恒温恒压条件下,这两组建立一个等效平衡,所以H2的转化率一样,所以C不正确。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
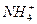 )=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(
)=2.0×10-6 mol·L-1、C(Cl-)=3.5×10-6 mol·L-1、C(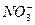 )=4.5×10-6 mol·L-1、C(
)=4.5×10-6 mol·L-1、C(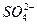 )=5.0×10-6 mol·L-1,则此雨水的pH约为( )
)=5.0×10-6 mol·L-1,则此雨水的pH约为( ) 氢氧化钠的PH=11水的离子积常数KW是多少?
氢氧化钠的PH=11水的离子积常数KW是多少?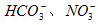
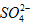 、Cl-、ClO-
、Cl-、ClO-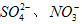
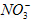 、Na+
、Na+