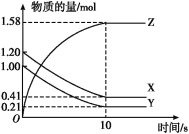
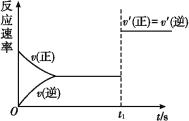
题目内容
【题目】下列离子方程式正确的是
A. 用惰性电极电解熔融氯化钠:2C1-+2H2O![]() C12↑+H2↑+2OH-
C12↑+H2↑+2OH-
B. 氢氧化钠溶液中加入过量的碳酸氢钙溶液: Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32-
C. 漂白粉溶液通入少量的SO2:Ca2++ 2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2+2H+=2Fe3++2H2O
【答案】D
【解析】
A.电解熔融氯化钠生成钠和氯气;
B.NaOH完全反应,生成水和碳酸钙的物质的量之比为1:1;
C.漂白粉溶液通入少量的SO2生成硫酸钙和盐酸;
D.硫酸亚铁酸性溶液中加入过氧化氢生成硫酸铁和水.
A.用惰性电极电解熔融氯化钠的离子反应为2Na++2Cl-![]() Cl2↑+2Na,故A错误;
Cl2↑+2Na,故A错误;
B.氢氧化钠溶液中加入过量的碳酸氢钙溶液的离子反应Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.漂白粉溶液通入少量的SO2的离子反应为Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl-,故C错误;
D.硫酸亚铁酸性溶液中加入过氧化氢的离子反应为2Fe2++H2O2+2H+=2Fe3++2H2O,故D正确;
故选D。

 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A | 将稀硫酸和碳酸钠反应生成的气体通入一定浓度的硅酸钠溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4 >H2CO3> H2SiO3 |
B | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液变为红色 | 溶液中一定含有Fe2+ |
C | 加热盛有氯化铵固体的试管 | 试管底部固体消失,试管口有晶体凝结 | 氯化铵固体可以升华 |
D | 向硫酸铜溶液中通入氯化氢气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
A. A B. B C. C D. D