题目内容
为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
①取21.4g样品,向其中加入足量NaOH溶液,测得生成标准状况下的气体体积为aL;
②取21.4g样品将其点燃,恰好完全反应;
③待②中反应产生物冷却后,加入足量盐酸,测得生成标状况下的气体体积为bL.
试求:
(1)样品中氧化铁和铝的质量比;
(2)所得气体的体积比a;b(本题要求写出计算步骤)
①取21.4g样品,向其中加入足量NaOH溶液,测得生成标准状况下的气体体积为aL;
②取21.4g样品将其点燃,恰好完全反应;
③待②中反应产生物冷却后,加入足量盐酸,测得生成标状况下的气体体积为bL.
试求:
(1)样品中氧化铁和铝的质量比;
(2)所得气体的体积比a;b(本题要求写出计算步骤)
(1)铝与氧化铁在高温下生成铁与氧化铝,反应方程式为2Al+Fe2O3
2Fe+Al2O3,
由二者恰好反应,根据方程式可知,n(Fe2O3):n(Al)=1:2,则二者的质量比为1mol×160g/mol:2mol×27g/mol=80:27,
答:样品中氧化铁和铝的质量比为80:27;
(2)由方程式2Al+Fe2O3
2Fe+Al2O3可知,②中生成的n(Fe)等于铝热剂中n(Al),即n(Al)=2n(Fe),
与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,即a:b=3n(Al):2n(Fe):=3:2,
答:所得气体的体积比3:2.
| ||
由二者恰好反应,根据方程式可知,n(Fe2O3):n(Al)=1:2,则二者的质量比为1mol×160g/mol:2mol×27g/mol=80:27,
答:样品中氧化铁和铝的质量比为80:27;
(2)由方程式2Al+Fe2O3
| ||
与盐酸反应生成的氢气体积之比等于金属提供的电子的物质的量之比,即a:b=3n(Al):2n(Fe):=3:2,
答:所得气体的体积比3:2.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为
g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为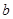 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。 L,该气体与(1)中所得气体的体积比
L,该气体与(1)中所得气体的体积比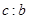 =_________。
=_________。 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为
g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为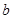 L。反应的化学方程式是_________________。样品中铝的质量是____________g。
L。反应的化学方程式是_________________。样品中铝的质量是____________g。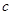 L,该气体与(1)中所得气体的体积比
L,该气体与(1)中所得气体的体积比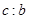 =_________。
=_________。