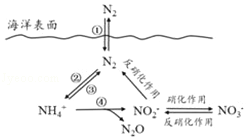
��Ŀ����
����Ŀ����ҩ���й��ġ��Ĵ�����֮һ����Զֵ�������セ����Ҳ��Զ�ἤ��������ȥ�ܷ�ͼǿ���ڻ�ҩ�ڷ�����ըʱ���������µķ�Ӧ��2KNO3+3C��S=K2S+N2��+3CO2����
��1�����б���ԭ��Ԫ���� �� ��������Ԫ���� �� �������� �� ��ԭ���� �� ���������� �� ��ԭ��������
��2����˫���ű������ת�Ƶķ������Ŀ��2KNO3+ 3C�� S �T K2S + N2��+ 3CO2����
��3����0.1molCO2����ʱ����ת�Ƶĵ�����Ϊ����
���𰸡�
��1��N��S��C��S��KNO3��C��CO2��N2��K2S
��2����:��ͼ��ʾ��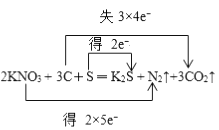
��3��0.4NA����2.408��1023
�����������⿼��������ԭ��Ӧ�м�����˫���ű�ʾ����ת�Ʒ����Լ�����ת����Ŀ��
��1�����������ϼ۽��ͣ�����ԭ�����ݷ�Ӧ����ʽ��N�Ļ��ϼ��ɣ�5�ۡ�0�ۣ�����ԭ��S�Ļ��ϼ���0�ۡ���2�ۣ����ϼ۽��ͣ�����ԭ����˱���ԭ��Ԫ����N��S����ԭ���ǻ��ϼ����ߣ���������C�Ļ��ϼ���0�ۡ���4�ۣ����ϼ����ߣ���˱�������Ԫ����C����������S��KNO3 �� ��ԭ����C�����������ǻ�ԭ���������õ����������������CO2 �� ��ԭ����������������ԭ�õ����ʣ���˻�ԭ������K2S��N2��
��2����˫���ű�ʾ�˷�Ӧת�Ƶķ������Ŀ����Ϊ  ��
��
��3��ת�Ƶ������ʵ���Ϊ0.1��4mol=0.4mol����ת�Ƶ��Ӹ���Ϊ0.4NA����2.408��1023��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�