题目内容
 计算:
计算:Ⅰ、(1)0.3mol NH3分子中所含氢原子数与
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,则此混合气体中CO物质的量为
(3)将标准状况下224L HCl气体溶于635mL水中(ρ=1g/cm3),所得盐酸的密度为1.18g/cm3.则此盐酸的物质的量浓度为
Ⅱ、如图,某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
(1)实验步骤如下:
①连接好实验装置,检查装置的气密性.
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95g.
③加热,开始反应,直到不再有气体产生为止.
④测量排入量筒中水的体积为285.0mL,换算成T℃,1O1kPa氧气的体积为360.0mL.
⑤准确称量试管和残留物的质量为15.55g.
(2)利用以上数据,本实验测得T℃,1O1kPa的气体摩尔体积为
分析:Ⅰ、(1)依据微粒数之比等于物质的量之比计算;
(2)依据气体摩尔体积计算物质的量n=
,结合二氧化碳和一氧化碳物质的量计算质量,列出方程组计算得到;
(3)根据n=
计算HCl的物质的量,根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的体积,根据c=
计算所得盐酸的物质的量浓度,
Ⅱ、依据实验数据和气体摩尔体积的概念是单位物质的量的气体所具有的体积计算.
(2)依据气体摩尔体积计算物质的量n=
| V |
| 22.4 |
(3)根据n=
| V |
| 22.4 |
| n |
| V |
Ⅱ、依据实验数据和气体摩尔体积的概念是单位物质的量的气体所具有的体积计算.
解答:解:Ⅰ、(1)0.3mol NH3分子中所含氢原子数为0.3mol×3=0.9mol,H2O分子中所含氢原子数相等为0.9mol,水分子个数=0.9mol×
×NA=0.45NA;
故答案为:0.45;
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,物质的量为1mol,设混合气体中二氧化碳物质的量为x,一氧化碳物质的量为1-x,44x+(1-x)28=36
x=0.5mol,
则此混合气体中CO物质的量1mol-0.5mol=0.5mol,CO2的质量=0.5mol×44g/mol=22g;
故答案为:0.5mol;22;
(3)224LHCl的物质的量为
=10mol,HCl的质量为10mol×36.5g/mol=365g,
635mL水的质量为635mL×1g/mL=635g,故溶液的质量为:635g+365g=1000g,
故所得盐酸的体积=
=
L,所得盐酸的物质的量浓度为:c=
=11.8mol/L;
故答案为:11.8mol/L;
Ⅱ、(2)试管和药品的总质量为15.95g,反应后准确称量试管和残留物的质量为15.55g,质量减小为生成氧气的质量,测得换算成T℃,1O1kPa氧气的体积为360.0mL,依据一定温度压强下气体摩尔体积的概念是单位物质的量的气体具有的体积计算得到,该温度下气体摩尔体积Vm=
=28.8L/mol;
故答案为:28.8 L/mol.
| 1 |
| 2 |
故答案为:0.45;
(2)在标准状况下36 克CO和CO2的混合气体的体积为22.4L,物质的量为1mol,设混合气体中二氧化碳物质的量为x,一氧化碳物质的量为1-x,44x+(1-x)28=36
x=0.5mol,
则此混合气体中CO物质的量1mol-0.5mol=0.5mol,CO2的质量=0.5mol×44g/mol=22g;
故答案为:0.5mol;22;
(3)224LHCl的物质的量为
| 224L |
| 22.4L/mol |
635mL水的质量为635mL×1g/mL=635g,故溶液的质量为:635g+365g=1000g,
故所得盐酸的体积=
| 1000g |
| 1180g/L |
| 50 |
| 59 |
| 10mol | ||
|
故答案为:11.8mol/L;
Ⅱ、(2)试管和药品的总质量为15.95g,反应后准确称量试管和残留物的质量为15.55g,质量减小为生成氧气的质量,测得换算成T℃,1O1kPa氧气的体积为360.0mL,依据一定温度压强下气体摩尔体积的概念是单位物质的量的气体具有的体积计算得到,该温度下气体摩尔体积Vm=
| 0.360L | ||
|
故答案为:28.8 L/mol.
点评:本题考查了物质的量和微粒数、质量、气体体积的计算关系应用,注意气体摩尔体积的概念分析计算,一定温度压强下,单位物质的量的气体体积为气体摩尔体积,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空: 过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.
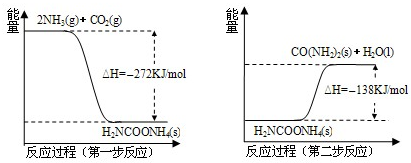
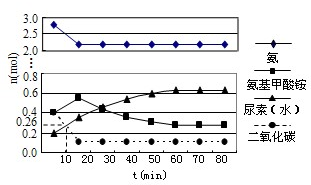
过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等.某化学兴趣小组同学围绕着过氧化氢开展了调查研究与实验.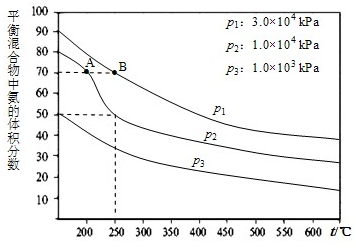 在工业合成尿素时常用NH3与CO2作原料进行生产.
在工业合成尿素时常用NH3与CO2作原料进行生产.