题目内容
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的PH=7 |
C.混合溶液中,c(H+)= 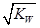 mol.L-1 mol.L-1 |
| D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
C
解析

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
常温下,向l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液,如图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是
| A.HA为一元强酸 |
| B.N点水的电离程度小于K点水的电离程度 |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005mol/L |
常温下,pH=12的NaOH溶液和pH=2的醋酸混合后恰好完全反应(不考虑溶液体积的变化)。下列说法正确的是
| A.反应后的溶液呈酸性 |
| B.两种反应物中水电离出的c(H+)都是1×10-12 mol·L-1 |
| C.反应后的溶液中:c(CH3COO-)+c(CH3COOH)=0.01mol·L-1 |
| D.反应后的溶液中:c(Na+) >c(CH3COO-)>c( OH-)>c(H+) |
下列物质的水溶液因发生水解而显酸性的是
| A.NH4Cl | B.KHSO4 | C.NaHCO3 | D.H2SO4 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  ?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
?[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
| 化学式 | 电离常数(298 K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
下列实验不能达到目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/LNaCl溶液,产生白色沉淀;再向其中滴加3滴0.1mol/L的KI溶液,有黄色沉淀产生 | 验证Ksp(AgCl)> Ksp(AgI) |
| B | 向适量样品溶液中滴加KSCN溶液 | 检验FeSO4溶液是否被氧化 |
| C | 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 | 检验Na2SO3溶液是否被氧化 |
| D | 向Na2SiO3溶液中通入CO2 | 验证非金属性:碳>硅 |
下列表达不正确的是
A.NaHS在水中的电离方程式为:NaHS=Na++HS- 和HS-  H++S2- H++S2- |
| B.同物质的量浓度的氨水和盐酸反应至中性时所用体积:V(NH3·H2O)<V(HCl) |
| C.Na2SO3溶液中:c(H+)+ c(HSO3-)+ 2c(H2SO3)= c(OH-) |
| D.同浓度的下列溶液中,c(CH3COO-)的大小:CH3COONa>CH3COONH4>CH3COOH |
下列实验操作不能达到其对应目的的是
| 序号 | 实验内容 | 实验目的 |
| A. | 向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有沉淀生成,再向其中滴加0.1 mol/L Na2S溶液 | 证明AgCl沉淀能转化为溶解度更小的Ag2S沉淀 |
| B. | 向2 mL甲苯中加入3滴KMnO4酸性溶液,振荡;向2mL己烷中加入3滴KMnO4酸性溶液,振荡 | 证明与苯环相连的甲基易被氧化 |
| C. | 向Na2SiO3溶液中通入CO2 | 证明碳酸的酸性比硅酸强 |
| D. | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜并加热 | 验证淀粉已水解 |
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
| A.与AlCl3溶液反应发生的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |