题目内容
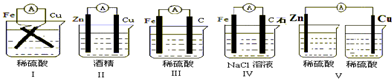
(1)下列装置能组成原电池的是

(2)对于锌-铜-稀硫酸组成的原电池装置,当导线中有1mol电子通过时,锌片溶解了
(3)如右图所示装置,若烧杯中溶液为氢氧化钠溶液,则负极为
(4)利用反应:Fe+2Fe3+=3Fe2+设计一个化学电池(电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料.
I、III、IV
I、III、IV
.(填序号)
(2)对于锌-铜-稀硫酸组成的原电池装置,当导线中有1mol电子通过时,锌片溶解了
32.5
32.5
g,铜片上析出11.2
11.2
升 H2(标准状况下).电池总反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
.
(3)如右图所示装置,若烧杯中溶液为氢氧化钠溶液,则负极为
铝
铝
,总反应方程为2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.该装置将化学能
化学能
能转化为电
电
能.(4)利用反应:Fe+2Fe3+=3Fe2+设计一个化学电池(电极材料和电解液自选),画出实验装置图,注明电解质溶液名称和正负极材料.
分析:(1)根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
(2)铜锌原电池中,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,根据锌、氢气和转移电子之间的关系式计算;
(3)该装置能自发的进行氧化还原反应,所以构成原电池,在该溶液中铝易失电子而作负极,则镁作正极;
(4)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料,电解质溶液为含Fe3+离子的溶液,如FeCl3.
(2)铜锌原电池中,负极上锌失电子发生氧化反应,正极上氢离子得电子发生还原反应,根据锌、氢气和转移电子之间的关系式计算;
(3)该装置能自发的进行氧化还原反应,所以构成原电池,在该溶液中铝易失电子而作负极,则镁作正极;
(4)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料,电解质溶液为含Fe3+离子的溶液,如FeCl3.
解答:解:(1)II中不能自发的进行氧化还原反应,所以不能构成原电池;
V中不能构成闭合回路,所以不能构成原电池,则Ⅰ、Ⅲ、Ⅳ符合原电池构成条件,所以能形成原电池,故选I、III、IV;
(2)该原电池中,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子生成氢气,所以电池反应式为:Zn+H2SO4=ZnSO4+H2↑,根据转移电子相等得,锌减少的质量=
×65g/mol=32.5g,生成氢气的体积=
×22.4L/mol=11.2L,
故答案为:32.5g,11.2L,Zn+H2SO4=ZnSO4+H2↑;
(3)该装置符合原电池的构成条件,所以是原电池,原电池是将化学能转变为电能的装置,铝在碱性溶液中比镁易失电子,所以铝作负极,负极上铝失电子和氢氧根离子反应生成偏铝酸根离子,正极上水得电子生成氢气,所以电池反应式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,化学能、电能;
(4)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料如碳棒,电解质溶液为含Fe3+离子的溶液,如FeCl3,
 ,
,
故答案为: .
.
V中不能构成闭合回路,所以不能构成原电池,则Ⅰ、Ⅲ、Ⅳ符合原电池构成条件,所以能形成原电池,故选I、III、IV;
(2)该原电池中,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上氢离子得电子生成氢气,所以电池反应式为:Zn+H2SO4=ZnSO4+H2↑,根据转移电子相等得,锌减少的质量=
| 1mol |
| 2 |
| 1mol |
| 2 |
故答案为:32.5g,11.2L,Zn+H2SO4=ZnSO4+H2↑;
(3)该装置符合原电池的构成条件,所以是原电池,原电池是将化学能转变为电能的装置,铝在碱性溶液中比镁易失电子,所以铝作负极,负极上铝失电子和氢氧根离子反应生成偏铝酸根离子,正极上水得电子生成氢气,所以电池反应式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,化学能、电能;
(4)在Fe+2Fe3+=3Fe2+反应中,Fe被氧化,应为原电池的负极,电解反应为:Fe-2e-=Fe2+,Fe3+得电子被还原,应为原电池正极反应,正极材料为活泼性比Fe的金属或非金属材料如碳棒,电解质溶液为含Fe3+离子的溶液,如FeCl3,
 ,
,故答案为:
 .
.点评:本题考查了原电池原理,难点是原电池的设计,这也是考试热点,根据电池反应式判断负极材料及电解质溶液,易错点是(3)题,注意不能根据电极材料的活泼性确定正负极,为易错点.

练习册系列答案
相关题目
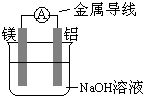

 (3) 如右图所示装置:若烧杯中溶液为氢氧化钠溶液,则负极为 ,总反应方程为
(3) 如右图所示装置:若烧杯中溶液为氢氧化钠溶液,则负极为 ,总反应方程为 


