题目内容
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
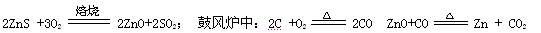
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
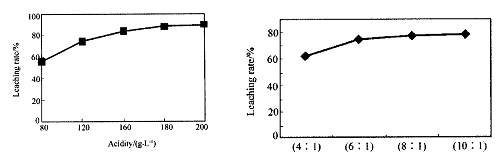
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为:
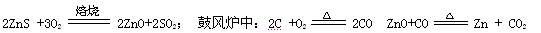
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2

图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
(1)①2mol/L(3分)② 180(2分);6∶1(2分)
(2)①将烟道气净化,用于生产硫酸等。(2分)②2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O(2分)
③Cd2+ + 2OH-=Cd(OH)2↓(2分),Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-= Zn(OH)42-]。(2分)
(1)①酸度为196,即196g/L,其物质的量浓度为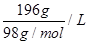 =2mol/L
=2mol/L
②从图像可看出:当酸度>180、液固比>6/1时,铟的浸出率保持在一定的水平,上升不再明显
(2)①烟气的主要成分为SO2,可净化、富集后制取硫酸
②根据化合升降守恒、电荷守恒及原子守恒,可配制此离子反应:2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O
③Cd2+离子与OH—全部沉淀:Cd2+ + 2OH-=Cd(OH)2↓,而Zn2+可与OH—生成沉淀后,沉淀溶于过量的碱液中:Zn2++2OH-=Zn(OH)2↓ Zn(OH)2+2OH-=ZnO22-+2H2O(或Zn2++4OH-=ZnO22-+2H2O、Zn2++4OH-= Zn(OH)42-)
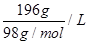 =2mol/L
=2mol/L②从图像可看出:当酸度>180、液固比>6/1时,铟的浸出率保持在一定的水平,上升不再明显
(2)①烟气的主要成分为SO2,可净化、富集后制取硫酸
②根据化合升降守恒、电荷守恒及原子守恒,可配制此离子反应:2Fe2+ +H2O2 +2H+ = 2Fe3+ +2H2O
③Cd2+离子与OH—全部沉淀:Cd2+ + 2OH-=Cd(OH)2↓,而Zn2+可与OH—生成沉淀后,沉淀溶于过量的碱液中:Zn2++2OH-=Zn(OH)2↓ Zn(OH)2+2OH-=ZnO22-+2H2O(或Zn2++4OH-=ZnO22-+2H2O、Zn2++4OH-= Zn(OH)42-)

练习册系列答案
相关题目
 ,为了防止事故,使用前可用于检验氯仿是否变质
,为了防止事故,使用前可用于检验氯仿是否变质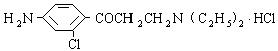 ,它可以以甲苯为原料合成
,它可以以甲苯为原料合成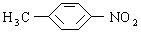 ,其反应方程式为______________________________________,再经过________________反应(填反应类型)来合成
,其反应方程式为______________________________________,再经过________________反应(填反应类型)来合成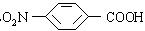 ,再经过一系列反应来合成。
,再经过一系列反应来合成。 可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的
可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的 分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。
分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。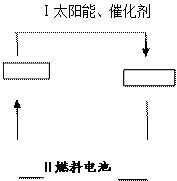
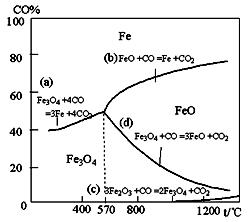
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: 。
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为: 。