题目内容
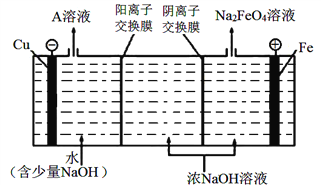
【题目】Ⅰ.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U形管中.
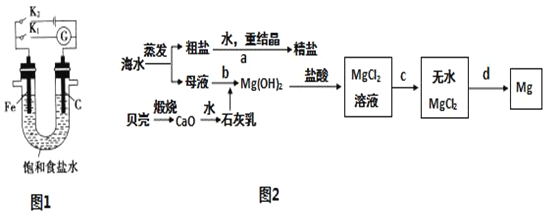
(1)仅K1闭合,石墨棒周围溶液pH升高,其电极反应式为___________________.
(2)仅K2闭合,在铁棒附近滴加酚酞显红色,理由是______________________(用平衡移动原理解释).
(3)仅K2闭合,发生总反应的离子方程式为________________________________.
Ⅱ. 海水的综合利用可以制备金属镁和精盐,其流程如图所示:
(1)步骤a中,溶解、过滤、蒸发三个阶段都要用到的一种玻璃仪器是________.
(2)为使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在___________.(常温下,Mg(OH)2的Ksp=1×10﹣11)
(3)步骤c必须在氯化氢气体的氛围中加热蒸发才能完成,试用化学方程式表示在无氯化氢的情况下不能生成无水MgCl2的原理_________________________________.
(4)完成步骤d的化学方程式____________________________.
【答案】 O2+4e﹣+2H2O=4OH﹣ H2OH++OH﹣,由于2H++2 e﹣=H2↑,使平衡正向移动,结果c(H+)<c(OH﹣) 2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ 玻璃棒 11 MgCl2+2H2O=Mg(OH)2↓+2HCl↑ MgCl2(熔融)
Cl2↑+H2↑+2OH﹣ 玻璃棒 11 MgCl2+2H2O=Mg(OH)2↓+2HCl↑ MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】Ⅰ.(1)K1闭合构成原电池,铁棒是负极,铁失去电子,石墨棒是正极,溶液中的氧气得到电子转化为OH-,石墨棒周围溶液pH逐渐升高,其电极反应式为:O2+4e﹣+2H2O=4OH﹣;(2)仅K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的水电离(H2OH++OH﹣)氢离子放电生成氢气,使平衡正向移动,结果c(H+)<c(OH﹣),溶液呈碱性,故在铁棒附近滴加酚酞显红色;(3)仅K2闭合构成电解池,铁棒与电源的负极相连,作阴极,溶液中的氢离子放电生成氢气。石墨棒是阳极,溶液中的氯离子放电生成氯气,故发生总反应的离子方程式为:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣ ;Ⅱ. (1)玻璃棒在溶解、过滤、蒸发三个阶段都要用到,故答案为玻璃棒;(2)
Cl2↑+H2↑+2OH﹣ ;Ⅱ. (1)玻璃棒在溶解、过滤、蒸发三个阶段都要用到,故答案为玻璃棒;(2)![]() ,常温下,Kw=1×10-14,
,常温下,Kw=1×10-14,![]() ,故使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在11;(3)氯化镁为强酸弱碱盐,能发生水解反应:MgCl2+2H2O=Mg(OH)2+2HCl,加热将会促进Mg2+水解和盐酸中的HCl挥发,使平衡向正反应方向进行,故不在氯化氢气流中加热氯化镁的方程式为:MgCl2+2H2O=Mg(OH)2↓+2HCl↑;(4)制备金属镁采用电解法,故步骤d的化学方程式为:MgCl2(熔融)
,故使母液中的Mg2+完全转化为Mg(OH)2(离子浓度小于10﹣5molL﹣1时,沉淀就达完全),步骤b中溶液的pH至少要控制在11;(3)氯化镁为强酸弱碱盐,能发生水解反应:MgCl2+2H2O=Mg(OH)2+2HCl,加热将会促进Mg2+水解和盐酸中的HCl挥发,使平衡向正反应方向进行,故不在氯化氢气流中加热氯化镁的方程式为:MgCl2+2H2O=Mg(OH)2↓+2HCl↑;(4)制备金属镁采用电解法,故步骤d的化学方程式为:MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案