��Ŀ����
����Ŀ���ҹ��Ŵ��Ĵ���֮һ�ĺڻ�ҩ������Ƿۡ�����غ�ľ̿�۰�һ��������϶��ɵģ���ըʱ�ķ�ӦΪS + KNO3 + C��K2S + N2��+ CO2�������ݸ÷�Ӧ�ش��������⣺
(1)��д����ƽ��Ļ�ѧ����ʽ_____________________________________________��
(2)д���÷�Ӧ��������_____________����ԭ��______________��
(3)��˫���ŷ�����÷�Ӧ����ת�Ƶķ������Ŀ____________________________��
(4)���÷�Ӧ��48������ȫ��Ӧ����ת�Ƶ��ӵ����ʵ���Ϊ____________�������������������Ϊ__________��
(5)���÷�Ӧת����0.6mol���ӣ������ɵ������ڱ�״���µ����Ϊ___________�����������ƽ����Է�������Ϊ________________��
(6)�����ɵ���������������Ȼ�ԭ�����������12�ˣ���ת�Ƶ��ӵ����ʵ���Ϊ____________���μӷ�Ӧ��̼������Ϊ_____________��
���𰸡�S + 2KNO3 + 3C��K2S + N2��+ 3CO2�� S��KNO3 C 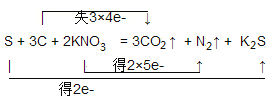 18mol 198g 4.48L 40 24mol 72 g
18mol 198g 4.48L 40 24mol 72 g
��������
(1)��ӦS + KNO3 + C��K2S + N2��+ CO2���У�SԪ�صĻ��ϼ۽���0�۱仯Ϊ-2�ۣ�NԪ�صĻ��ϼ۽���+5�۱仯Ϊ0�ۣ�CԪ�صĻ��ϼ�����0�۱仯Ϊ+4�ۣ�����ת������12e-����ϵ����غ���ƽ��д��ѧ����ʽΪ��S+2KNO3+3C�TK2S+N2��+3CO2����
(2)��ӦS+2KNO3+3C�TK2S+N2��+3CO2���У�N��SԪ�ػ��ϼ۽��ͣ�����ԭ����KNO3����Ϊ��������CԪ�ػ��ϼ����ߣ���������CΪ��ԭ����
(3)�÷�Ӧ��ת�Ƶ�������Ϊ12e������ת�Ƶĵ��ӷ������ĿΪ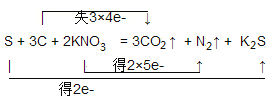 ��
��
(4) �ɷ�ӦS+2KNO3+3C�TK2S+N2��+3CO2����֪�����÷�Ӧ��48����1.5mol��ȫ��Ӧ����ת�Ƶ��ӵ����ʵ���Ϊ1.5mol��12=18mol��������������CO2������Ϊ1.5mol��3��44g/mol=198g��
(5) �ɷ�ӦS+2KNO3+3C�TK2S+N2��+3CO2����֪��Ӧ��ת�Ƶ�������Ϊ12e�������÷�Ӧת����0.6mol���ӣ������ɵ������ڱ�״���µ����Ϊ![]() �����������ƽ����Է�������Ϊ
�����������ƽ����Է�������Ϊ![]() ��
��
(6) S+2KNO3+3C�TK2S+N2��+3CO2�� �������� ��ԭ���� ������ ת�Ƶ���
36 110 28 132 138 132 6 12 e��
72g 12g 24mol
�����ɵ���������CO2�������Ȼ�ԭ����K2S����������12�ˣ���ת�Ƶ��ӵ����ʵ���Ϊ24mol���μӷ�Ӧ��̼������Ϊ72g��


