题目内容
【题目】苯乙酸铜是合成优良催化剂、传感材料纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:


制备苯乙酸的装置如右图所示(加热和夹持装置等略),已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。回答下列问题:(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____________________。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是______________;仪器c的名称是__________,其作用是__________________。反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是_______。下列仪器中可用于分离苯乙酸粗品的是___________(填标号)。
A.分液漏斗 B.漏斗C.烧杯 D.直形冷凝管 E.玻璃棒
【答案】 先加水,再加浓硫酸 滴加苯乙腈 球形冷凝管 回流(或使气化的反应液冷凝) 便于苯乙酸析出 BCE
【解析】本题主要考查对于实验室制备苯乙酸方法的评价。
(1)配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是先加水,再加浓硫酸。
(2)在装置中,仪器b的作用是滴加苯乙腈;仪器c的名称是球形冷凝管,其作用是回流(或使气化的反应液冷凝)。苯乙酸微溶于冷水,加人冷水可以减小苯乙酸的溶解度,目的是便于苯乙酸析出。分离苯乙酸使用过滤的方法,下列仪器中可用于分离苯乙酸粗品的是BCE。

【题目】化学是一门实验科学,化学反应过程中的能量变化和速率变化是中学化学研究的重要内容
Ⅰ.利用如图所示装置测定中和热
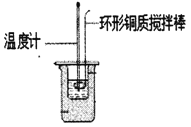
(1)图中明显有一处错误,请指出___________
(2)________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定
Ⅱ.探究硫酸铜的量对氢气生成速率的影响。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需的时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
(1) 请完成此实验设计,其中: V8=_________
(2) 当CuSO4溶液少量时,反应速率明显加快,原因_______
(3) 当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:______________