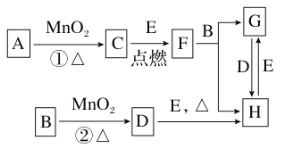
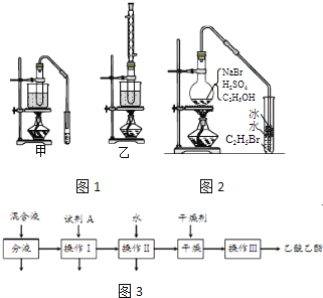
��Ŀ����
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ��Fe2+��������Ե�ʡ��ش��������⣺
(1)���õ�FeSO4��Һ��Fe3+�ļ��飺����õ�FeSO4��Һ�м���KSCN������Ϊ��______________________________
(2)��ȥ����FeSO4��Һ��Fe3+������Һ�м����������ۣ����Թ۲쵽������Ϊ��______________________����Ӧ�����ӷ���ʽΪ��____________________________
(3)�������ϣ���Һ��Fe2+���������̷�Ϊ������������Fe2+ˮ��ΪFe(OH)2������ˮ����ﱻO2������д��Fe(OH)2�ڿ����б�����������Ϊ_________________________д����ѧ����ʽ������˫���ű�ע����ת�ƣ�________________________________
���𰸡���Һ�ɻ�ɫ���Ѫ��ɫ ��Һ�ɻ�ɫ���dz��ɫ 2Fe3+ +Fe=3Fe2+ ��ɫ��״���ɻ���ɫ������ɺ��ɫ���� 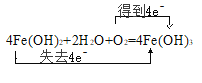
��������
��1��![]() ������Ϊ
������Ϊ![]() ��
��![]() ����KSCN��Һ��ʾѪ��ɫ��
����KSCN��Һ��ʾѪ��ɫ��
��2��![]() ���������ԣ�
���������ԣ�![]() ��
��
��3��![]() Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ������������ԭ��Ӧ���ɱ������ת�Ƶ������
Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ������������ԭ��Ӧ���ɱ������ת�Ƶ������
��1��![]() ��ҺΪ��ɫ��
��ҺΪ��ɫ��![]() ����KSCN��Һ��ʾѪ��ɫ������Һ�л�ɫ��ΪѪ��ɫ��
����KSCN��Һ��ʾѪ��ɫ������Һ�л�ɫ��ΪѪ��ɫ��
��2�������Ӿ��������ԣ������۷�Ӧ�����������������ӣ���Ӧ�����ӷ���ʽΪ��![]() ������Һ�ɻ�ɫ��Ϊdz��ɫ��
������Һ�ɻ�ɫ��Ϊdz��ɫ��
��3��![]() Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ��������Ӧ�ķ���ʽΪ��
Ϊ��ɫ��״����������������Ϊ��ɫ��״���ɻ���ɫ������ɺ��ɫ��������Ӧ�ķ���ʽΪ��![]() ����Ӧ����Ԫ����0�۽��͵�-2�ۣ�������������4�ۣ�ת���˵���4e-��˫���ű�ʾ����ת��Ϊ��
����Ӧ����Ԫ����0�۽��͵�-2�ۣ�������������4�ۣ�ת���˵���4e-��˫���ű�ʾ����ת��Ϊ�� ��
��