题目内容
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。 已知:
| 化学键 | N≡N | H—O | N—H | O=O |
| 键能/kJ·mol-1 | 945 | 463 | 391 | 498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6mo1/L) | 4.8 | 5.9 | 6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲ 、 ▲ ;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:
① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲ 。
② 煅烧炉中产生的固态副产品为 ▲ ,生产流程中能被循环利用的物质X为 ▲ 。
(14分)
(1)N2(g) + 3H2O( g)2NH3(g) +
![]() O2(g); △H = + 630 kJ·mol-1 (3分)
O2(g); △H = + 630 kJ·mol-1 (3分)
(2)①2.5×l0-8 mol/(L·min)或①1.5×l0-6mol/(L·h) (2分)
②升高温度;增大压强; (合理均可,2分)
(3)①氨在水中溶解度大,使溶液呈碱性,有利于吸收CO2,增大c(CO32-),促使CaSO4转化为CaCO3,同时生成(NH4)2SO4 (3分)
②CaO(或生石灰) CO2(或二氧化碳) (各2分,共4分)
解析:

一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+ 3H2O![]() 2NH3+
2NH3+![]() O2.
O2.
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10 | 4.8 | 5.9 | 6.0 |
请回答下列问题:
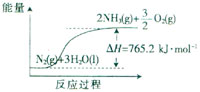 (1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为 mol/min。
(2)该反应过程与能量关系可用右图表示.完成反应的热化学方程式: 。
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(4)工业合成氨的反应为N2(g)+3 H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
2NH3(g)。设在容积为2.0 L的密闭容器中充人0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
① 该条件下反应2NH3(g)![]() N2(g)十3H2(g)的平衡常数为 。
N2(g)十3H2(g)的平衡常数为 。
② 相同条件下,在另一相同容器中充人a mol N2(g)和b mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mo1,H2为2.0 mol,则![]() ,
,![]()
(14分)一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。 已知:
|
化学键 |
N≡N |
H—O |
N—H |
O=O |
|
键能/kJ·mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
|
T/℃ |
30 |
40 |
50 |
|
生成NH3量/(10-6mo1/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲ ;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲ 、 ▲ ;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下:

① 往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲ 。
② 煅烧炉中产生的固态副产品为 ▲ ,生产流程中能被循环利用的物质X为 ▲ 。
 2NH3(g)+
2NH3(g)+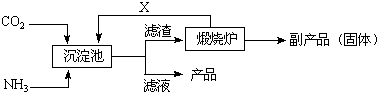
 。若加入少量醋酸钠固体,则CH3COOH
。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小
CH3COO-+H+向左移动,α减小,Ka变小 不能自发进行,则该反应的
不能自发进行,则该反应的
 NH3·H2O+H+,若用KW表示的离子积,
NH3·H2O+H+,若用KW表示的离子积,
