题目内容
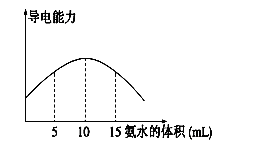
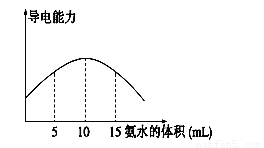
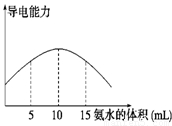
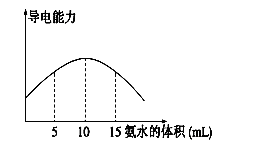
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH="3" 的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
- A.1%
- B.1.5%
- C.0.5%
- D.0.1%
A
试题分析:醋酸是弱酸,和氨水反应生成醋酸铵,醋酸铵是强电解质,因此溶液的导电性增强。根据图像可知,当溶液导电性最强时,消耗氨水是10ml,此时恰好反应,所以醋酸的浓度是 。醋酸溶液中氢离子的浓度是0.001mol/L,则醋酸的电离度是
。醋酸溶液中氢离子的浓度是0.001mol/L,则醋酸的电离度是 ,答案选A。
,答案选A。
考点:考查电离度的有关计算
点评:该题是信息给予题,属于中等难度的试题,试题难易适中,灵活性强,注重考查学生分析、归纳、总结问题的能力,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是计算醋酸的浓度,而难点是结合图像分析,得出恰好反应时消耗氨水的体积。
试题分析:醋酸是弱酸,和氨水反应生成醋酸铵,醋酸铵是强电解质,因此溶液的导电性增强。根据图像可知,当溶液导电性最强时,消耗氨水是10ml,此时恰好反应,所以醋酸的浓度是
 。醋酸溶液中氢离子的浓度是0.001mol/L,则醋酸的电离度是
。醋酸溶液中氢离子的浓度是0.001mol/L,则醋酸的电离度是 ,答案选A。
,答案选A。考点:考查电离度的有关计算
点评:该题是信息给予题,属于中等难度的试题,试题难易适中,灵活性强,注重考查学生分析、归纳、总结问题的能力,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是计算醋酸的浓度,而难点是结合图像分析,得出恰好反应时消耗氨水的体积。

练习册系列答案
相关题目