题目内容
将1.92g 铜与一定量浓硝酸反应,当铜完全反应后收集到1.12L气体。如果将此气体通过足量的水,最后剩余气体的体积(标准状况下)为 ( )。A.0.677L B.0.56L C.0.448L D.0.4032L
C
【试题分析】
解析:依题意知,最后剩余的气体为NO。1.92gCu与一定量浓硝酸反应生成1.12L气体,所失去的电子数与
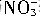 转化为NO得到的电子数是相等的。因此,可假设Cu与浓硝酸反应直接生成NO,再由该假设的化学方程式求NO的体积,3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O。
转化为NO得到的电子数是相等的。因此,可假设Cu与浓硝酸反应直接生成NO,再由该假设的化学方程式求NO的体积,3Cu+8HNO3(浓)=3Cu(NO3)2+2NO↑+4H2O。由n(Cu)=1.92g/64g?mol-1=0.03mol,可得n(NO)=0.02mol,V(NO)=0.448L。故答案为C。

练习册系列答案
相关题目

 CuO
CuO CuSO4
CuSO4  Cu(NO3)2
Cu(NO3)2 Cu(OH)2
Cu(OH)2 CuSO4
CuSO4 CuSO4
CuSO4 CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.
CuO+SO2↑+SO3↑+O2↑为此他们设计了如图所示实验装置测定有关数据,并经计算确定该条件下CuSO4分解反应方程式中各物质的化学计量数.