题目内容
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s) mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO2- 4] =1.1×10-12
试求:此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度。
(6分)c(AgCl)=1.8×10-8(mol/L); c(Ag2CrO4)=1.1×10-8 (mol/L)
【解析】
试题分析:在0.010 mol/L AgNO3溶液中,c(Ag+)=0.010 mol/L

溶解平衡时:(0.010+x)·x=1.8×10-10
因为x很小
所以0.010+x ≈0.010
解得x=1.8×10-8(mol/L)
即c(AgCl)=1.8×10-8(mol/L)
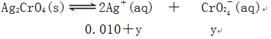
溶解平衡时:(0.010+2y)2·y=1.1×10-12
因为y很小
所以0.010+2y≈0.010
解得y=1.1×10-8(mol/L)
即c(Ag2CrO4)=1.1×10-8 (mol/L)
考点:考查溶度积常数的有关计算
点评:该题是高考中的常见考点,属于中等难度的试题。主要是考查学生对溶度积常数含义以及表达式的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力,有利于培养学生的逻辑思维能力和规范答题能力。

 阅读快车系列答案
阅读快车系列答案
|
![]() KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
![]()
有关数据如下表:
| 熔点℃ | 沸点℃ | 密度(g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
有关数据如下表:
|
| 熔点℃ | 沸点℃ | 密度(g/cm3) |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500(升华) | 1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:

有关数据如下表:
|
|
熔点℃ |
沸点℃ |
密度(g/cm3) |
|
Na |
97.8 |
882.9 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
(1)工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。
|
 KCl + Na NaCl + K + Q (Q<0)
KCl + Na NaCl + K + Q (Q<0)
有关数据如下表:
|
|
熔点℃ |
沸点℃ |
密度(g/cm3) |
|
Na |
97.8 |
882.9 |
0.97 |
|
K |
63.7 |
774 |
0.86 |
|
NaCl |
801 |
1413 |
2.165 |
|
KCl |
770 |
1500(升华) |
1.984 |
(1) 工业上制取金属钾的化学原理是 ,在常压下金属钾转为气态从反应混合物中分离的最低温度约为 ,而反应的最高温度应低于 。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是 。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,
且将该气体可循环利用,该气体是________。
a.干燥的空气 b.氮气 c.二氧化碳 d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K= 。