题目内容
物质X是某反应中的生成物,其质量先增大后减小,下列各操作中指定物质数量变化符合此特征的是
| A | B | C | D | |
| 操作 | 向NaClO溶液中通入SO2 | 向NaCO3溶液中滴加盐酸 | 向NaHCO3溶液中滴加石灰水 | 向KBr溶液中滴加稀氯水 |
| X | Na2SO3 | NaCl | Na2CO3 | Br2 |
- A.A
- B.B
- C.C
- D.D
A
分析:A、向NaClO溶液中通入SO2,生成的Na2SO3质量增大,继续通入生成亚硫酸氢钠;
B、向Na2CO3溶液中滴加盐酸,反应过程中氯化钠质量增多;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变.
解答:A、向NaClO溶液中通入SO2,生成的Na2SO4,继续通入质量不变,故A不符合;
B、向Na2CO3溶液中滴加盐酸,生成碳酸氢钠和氯化钠,继续滴加反应过程中氯化钠质量增多,故B不符合;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小,故C符合;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变,故D不符合;
故选C.
点评:本题考查了钠及其化合物性质的应用,注意反应过程中量不同产物不同,物质性质是解题的关键,题目难度中等.
分析:A、向NaClO溶液中通入SO2,生成的Na2SO3质量增大,继续通入生成亚硫酸氢钠;
B、向Na2CO3溶液中滴加盐酸,反应过程中氯化钠质量增多;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变.
解答:A、向NaClO溶液中通入SO2,生成的Na2SO4,继续通入质量不变,故A不符合;
B、向Na2CO3溶液中滴加盐酸,生成碳酸氢钠和氯化钠,继续滴加反应过程中氯化钠质量增多,故B不符合;
C、向NaHCO3溶液中滴加石灰水,开始生成碳酸钙和碳酸钠,继续滴加碳酸钠减小,故C符合;
D、向KBr溶液中滴加稀氯水,反应过程中生成溴单质质量增大后不变,故D不符合;
故选C.
点评:本题考查了钠及其化合物性质的应用,注意反应过程中量不同产物不同,物质性质是解题的关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
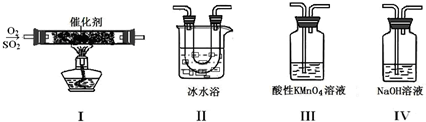
某小组同学欲研究SO2的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是 。
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)

①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 。
②甲同学按Ⅰ、Ⅱ、Ⅲ、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ;装置Ⅲ中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是 。
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40 mL 2.5mol/L NaOH溶液,反应后增重4.8 g,则装置Ⅳ中发生反应的化学方程式是 。
 2NH3(g); △H<0
2NH3(g); △H<0
 2NH3(g);△H<0
2NH3(g);△H<0