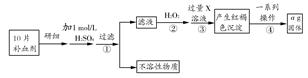
题目内容
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
B
由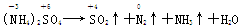 知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。
知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。
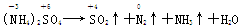 知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。
知,1 mol氮原子参加氧化反应失去了3 mol e-,1 mol硫原子参加还原反应得到2 mol e-;又因为(NH4)2SO4中,n(N):n(S)=2:1,在强热下分解,根据氧化还原反应得失电子数相等,发生氧化还原反应化合价变化的n(N):n(S)=2:3,若(NH4)2SO4中含S原子3 mol,那么含氮原子应为3×2 mol,故化合价发生变化和未发生变化的N原子数之比为2:(3×2-2)=1:2,B项正确。
练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
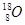
 代表阿伏加德罗常数,下列说法不正确的是
代表阿伏加德罗常数,下列说法不正确的是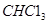 )中含有
)中含有 键的数目为1.5
键的数目为1.5 )所含的电子数为9
)所含的电子数为9