题目内容
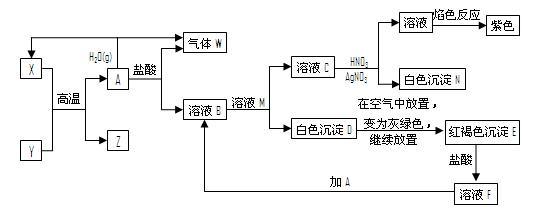
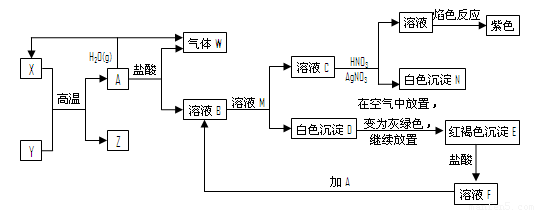
A、Y为常见金属单质,X为常见非金属单质。常温下X、G、H、I为气体,C为液体。B是由三种元素组成的盐,加热时发生分解生成两种气体,冷却后又可化合得到B。有关物质之间的转化关系如下图(部分反应条件及生成物略去)

请填写下列空白:
(1)B的电子式为 ;
(2)D固体可用于净水,请用相应的离子方程式及简单文字说明原因:
;
(3)反应⑥的化学方程式为 ;
反应④在冶金工业上属于 (填金属的冶炼方法);
(4)从D的结晶水合物制备D的无水晶体的操作为 ;
(5)反应②的化学方程式为 ;
反应③的离子方程式为 ;
(6)收集一试管H,将其倒置于水槽中,然后向试管中通入一定量的O2使试管内液面上升,最终剩余气体占试管容积的一半,则原有H与所通入O2的体积比为 。
除(6)外,每空2分)
(1)NH4Cl的电子式略
(2)AlCl3固体溶于水,电离产生的Al3+可水解Al3++3H2O Al(OH)3(胶体)+3H+,
Al(OH)3(胶体)+3H+,
生成的Al(OH)3胶体可吸附水中杂质,达到净水目的。 (离子方程式书写正确给1分,提到Al(OH)3胶体可吸附给1分)
(3)3Fe+4H2O(g) 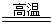 Fe3O4+4H2
热还原法(或铝热还原法)
Fe3O4+4H2
热还原法(或铝热还原法)
(4)将D的结晶水合物在HCl气流中加热 (提到HCl气体即给满分)
(5)
Al3++3NH3·H2O=Al(OH)3↓+3NH+ 4(或Al3++3NH3+3H2O=Al(OH)3↓+3NH+ 4)
(6)8:3或4:5 (各1分)
【解析】

 以下各物质均为中学阶段常见的物质,其中B是单质,它们的转化关系如图所示:
以下各物质均为中学阶段常见的物质,其中B是单质,它们的转化关系如图所示: