题目内容
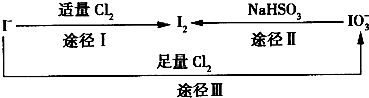
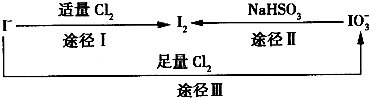
在地壳中主要以Nal0,的形式存在,在海水中主要以I-的形式存在,几种粒子之间的转化关系如图所示.下列说法中不正确的是
- A.用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝
- B.足量Cl2能使湿润的、已变蓝的淀粉-KI试纸褪色的原因可能是5Cl2+I+6H2O═2HI03+10HCl
- C.由图可知氧化性的强弱顺序为Cl>I>IO
- D.途径Ⅱ中若生成1 mol I,则反应中转移的电子数为10NA
C
分析:A.加碘盐中含有NaIO3,其在酸性条件下可被I-还原生成I2;
B.根据图示转化Ⅲ可知Cl2>NaIO3,氯气可以将碘氧化HIO3;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3;
D.根据转化关系2IO3-~I2~10e-计算判断.
解答:A.加碘盐中含有NaIO3,其在酸性条件下可被I-还原生成I2,故用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝,故A正确;
B.根据图示转化Ⅲ可知Cl2>NaIO3,已变蓝的淀粉-KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O═2HI03+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>IO3->I2,故C错误;
D.根据转化关系2IO3-~I2~10e-可知,生成1 molI2反应中转移的电子数为10NA,故D正确;
故选C.
点评:本题考查氧化性强弱比较及应用,难度中等,根据转化关系判断氧化性强弱是解题关键.
分析:A.加碘盐中含有NaIO3,其在酸性条件下可被I-还原生成I2;
B.根据图示转化Ⅲ可知Cl2>NaIO3,氯气可以将碘氧化HIO3;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3;
D.根据转化关系2IO3-~I2~10e-计算判断.
解答:A.加碘盐中含有NaIO3,其在酸性条件下可被I-还原生成I2,故用淀粉-KI试纸和食醋检验加碘盐时淀粉-KI试纸会变蓝,故A正确;
B.根据图示转化Ⅲ可知Cl2>NaIO3,已变蓝的淀粉-KI试纸褪色的原因可能是氯气将碘氧化为HIO3,反应方程式为5Cl2+I2+6H2O═2HI03+10HCl,故B正确;
C.由途径I可知氧化性Cl2>I2,由途径Ⅱ可知氧化性I2<NaIO3,由途径Ⅲ可知氧化性Cl2>NaIO3,故氧化性的强弱顺序为Cl2>IO3->I2,故C错误;
D.根据转化关系2IO3-~I2~10e-可知,生成1 molI2反应中转移的电子数为10NA,故D正确;
故选C.
点评:本题考查氧化性强弱比较及应用,难度中等,根据转化关系判断氧化性强弱是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目