题目内容
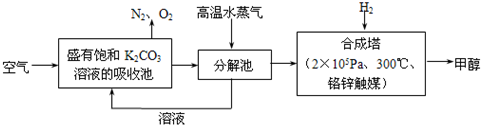
(15分)为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式是 。
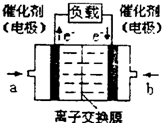
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e- ==== CO2 + 6H+
则正极发生的反应是 ;放电时,H+移向电池的 (填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+ 的平衡常数K = 。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
(1)CO2(g)+3H2(g)=== CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol(3分)
(2)O2 + 4H+ + 4e- =2 H2O (2分) 正 (2分)
(3)4.2×10-7 mol·L-1 (3分)
(4)> (1分) 因为既存在 HCO3-CO32-+H+ 也存在HCO3-+H2O
H2CO3+OH-、而HCO3-的水解程度大于电离程度 (2分)
(5)Ba(OH)2(或NaOH溶液和BaCl2溶液) (2分)
解析:

 (2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
(2012?信阳二模)如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.